微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氧化还原反应广泛应用于金属的冶炼。下列说法错误的是
A.冶炼铁是在高温下利用还原反应将铁从其铁矿石中还原出来
B.炼钢是在高温下利用氧化剂把生铁中过多的碳和其他杂质氧化
C.1molFe3O4被CO全部还原成Fe时,转移9mol电子
D.铝热法还原铁的反应,可放出大量的热,并能使铁熔化
参考答案:C
本题解析:略
本题难度:一般
2、选择题 将Fe(OH)2露置在空气中加热灼烧所得的产物为
[???? ]
A.FeO
B.Fe2O3
C.Fe3O4
D.Fe(OH)3
参考答案:B
本题解析:
本题难度:简单
3、选择题 FeCl3,CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
A.加入KSCN溶液变红色
B.溶液中一定含Fe2+
C.溶液中一定含Cu2+
D.剩余固体中一定含Cu
参考答案:分阶段分析
①、当固体为铁、铜时,溶液中的Fe3+、C
本题解析:
本题难度:一般
4、实验题 某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
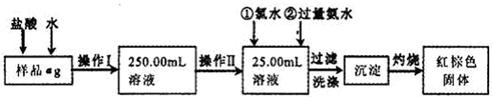
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯.玻璃棒.量筒外,还必须有____________ (填自选仪器名称),操作II必须用到的仪器是____________(填编号)。
???
A.50mL烧杯
B.50mL量筒
C.25mL碱式滴定管
D.25mL酸式滴定管
(2)洗涤是洗去附着在沉淀上的____________。(写离子符号)
(3)检验沉淀是否已经洗涤干净的操作是________________________。
(4)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是____________。
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是____________。
(6)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的。他的理由是________________________。(用化学方程式表示)
参考答案:
(1)250mL容量瓶.胶头滴管;D
(2)N
本题解析:略
本题难度:一般
5、选择题 下列反应中,通过调节反应物的用量或浓度可以改变反应产物的是[???? ]
A、硫在氧气中燃烧
B、铁粉与硫粉混合加热
C、铜在空气中加热
D、铜与硝酸反应
参考答案:D
本题解析:
本题难度:简单