微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 1.2 mol氯气与元素A的单质完全反应生成0.8 mol的氯化物ACLx,则x值为
A.1
B.2
C.3
D.4
参考答案:C
本题解析:解法一:根据方程式计算
2A+xCl2![]() 2AClx
2AClx
x mol ???????2 mol
1.2 mol?????? 0.8 mol
x=3
解法二:根据氧化还原反应得失电子总数相等关系求解
设A的化合价为x,
则A失去的电子为0.8x mol,
Cl2得到的电子为1.2 mol×2=2.4 mol,
故0.8x=2.4,x=3。
解法三:因为两者完全反应,所以AClx中的氯原子和氯气中的氯原子守恒,
即0.8x=1.2×2x=3。
本题难度:简单
2、选择题 下列各组有机物中,使用溴水不能鉴别出的是
A.苯和四氯化碳
B.乙酸和酒精
C.乙烷和乙烯
D.苯和酒精
参考答案:B
本题解析:
答案:B
A、苯密度小于水、四氯化碳密度大于水??? B.乙酸和酒精与湨水混溶; C.乙烯能使溴水褪色;???? D.苯密度水于水,浮于水上,酒精和湨水混溶。
本题难度:一般
3、选择题 用加热方法可分离的一组是
A.氯化铵和消石灰
B.碳铵和过氧化钠
C.碘和食盐
D.氯化铵和氯化钡
参考答案:CD
本题解析:A选项中氯化铵和消石灰[Ca(OH)2]在加热时会发生化学反应:2NH4Cl+Ca(OH)2 NH3↑+CaCl2+2H2O,因此不能实现分离的目的;B选项中碳铵[NH4HCO3]加热分解,生成的CO2、H2O都能和过氧化钠反应,因此也不能分离;C中利用碘受热易升华的性质,能与食盐分离;D中氯化铵分解产生氨气和氯化氢气体,氯化钡不分解,而氨气和氯化氢有可重新化合成氯化铵,能实现分离。
NH3↑+CaCl2+2H2O,因此不能实现分离的目的;B选项中碳铵[NH4HCO3]加热分解,生成的CO2、H2O都能和过氧化钠反应,因此也不能分离;C中利用碘受热易升华的性质,能与食盐分离;D中氯化铵分解产生氨气和氯化氢气体,氯化钡不分解,而氨气和氯化氢有可重新化合成氯化铵,能实现分离。
本题难度:简单
4、选择题 只用一种试剂就能将甲苯,己烯、四氯化碳、碘化钾溶液区分开,这种试剂是(???)
A.KMnO4溶液
B.KBr溶液
C.溴水
D.AgNO3溶液
参考答案:C
本题解析:高锰酸钾溶液只和四氯化碳不反应,A不正确。溴化钾与四种物质都不反应,B不正确。溴水和甲苯发生萃取,有机层在上层,和己烯发生加成反应,和四氯化碳也是发生萃取,但有机层在下层,和碘化钾发生氧化还原反应,生成单质碘,C正确。硝酸银溶液只能和碘化钾反应,生成黄色沉淀,所以正确的答案选C。
本题难度:简单
5、填空题 CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物
| Fe(OH)3
| Fe(OH)2
| Co(OH)2
| Al(OH)3
| Mn(OH)2
|
开始沉淀
| 2.7
| 7.6
| 7.6
| 4.0
| 7.7
|
完全沉淀
| 3.7
| 9.6
| 9.2
| 5.2
| 9.8
?
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式________________________。
(2)写出NaClO3发生反应的主要离子方程式_____________________________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_______________。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为???????????????????。
(4)“操作1”中包含3个基本实验操作,它们依次是_________、__________和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________;其使用的最佳pH范围是________________。
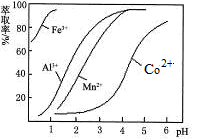
A.2.0~2.5?????B.3.0~3.5?????????C.4.0~4.5?????D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是_____________________。(答一条即可)
参考答案:(1)Co2O3+SO32-+4H+=2Co2++SO42-
本题解析:
试题分析:(1)向水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]
加入盐酸和亚硫酸钠,浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,所以Co2O3和亚硫酸钠在酸性条件下发生氧化还原,根据电荷守恒和得失电子守恒,反应为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;
(2)加入NaClO3,会发生FeCl2中铁元素的化合价+2→+3,失去电子,NaClO3中氯元素的化合价由+5→-1价,得到电子,根据电荷守恒和得失电子守恒,反应为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,“浸出液”中加过量NaClO3时,有毒气体是氯气,所以推断是NaClO3和“浸出液”中的氯离子发生了氧化还原反应,ClO3-中Cl元素的化合价由+5价降低为0价,HCl中Cl元素的化合价由-1价升高到0,根据电子守恒及质量守恒定律来配平,所以其方程式为:KClO3+6HCl=KCl+3Cl2↑+3H2O,离子方程式是ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
(3)加Na2CO3调pH至5.2,铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑;故答案为:Fe(OH)3、Al(OH)3;
(4)从溶液中制取固体的方法制取氯化钴固体,其操作步骤是蒸发浓缩、冷却结晶和过滤,根据题意知,CoCl2·6H2O常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴,为防止其分解,制得的CoCl2·6H2O需减压烘干;
(5)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子,由萃取剂对金属离子的萃取率与pH的关系可知
调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,故答案为:除去溶液中的Mn2+;选B;??????????????????????
(6)根据CoCl2·6H2O的组成分析,造成产品中CoCl2·6H2O的质量分数大于100%的原因可能是:含有杂质,导致氯离子含量大,结晶水化物失去部分水,导致相同质量的固体中氯离子含量变大。2·6H2O的工艺流程。
本题难度:困难
|