微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 铝土矿(主要成分为Al2O3,还有少量杂质)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
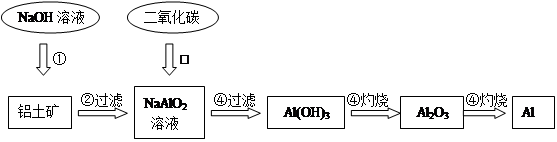
(1)请用离子方程式表示以上工艺流程中第①步反应:_______?????????????????????????????_______。
(2)写出以上工艺流程中第③步反应的化学方程式:______?????????????????????????????___________。
(3)金属铝与氧化铁混合在高温下,会发生剧烈的反应。该反应的化学方程式_____________。请举一例该反应的用途________________。
(4)电解熔融氧化铝制取金属铝,若有0.9mol电子发生转移.理论上能得到金属铝的质量是________________。
参考答案:(1)Al2O3+2OH-=2AlO2-+H2O?
(
本题解析:
试题分析:(1)因题目已经给出了铝土矿的主要成分是Al2O3,所以第一步反应中与NaOH溶液反应的是Al2O3,Al2O3+2OH-=2AlO2-+H2O
(2)结合实验室制取Al(OH)3的原理,我们可以写出反应方程式NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
(3)铝热反应方程式:2Al+Fe2O3=2Fe+Al2O3。
(4) 本题难度:一般
本题难度:一般
2、填空题 (10分)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成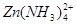 。
。
回答下列问题:
(1)写出锌和氢氧化钠溶液反应的化学方程式
___________________________________________________??????????????。
(2)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是????????。
①硫酸铝和氢氧化钠?????②硫酸铝和氨水
③硫酸锌和氢氧化钠?????④硫酸锌和氨水
(3)写出可溶性铝盐与氨水反应的离子方程式
______________________________________________________???????????。
(4)试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因
__________________________________________??????? ________________。
参考答案:(1)Zn+2NaOH===Na2ZnO2+H2↑?(2分)
本题解析:(1)Zn+2NaOH===Na2ZnO2+H2↑
(2)①③④相似,将硫酸盐滴加于碱液中,一开始没有沉淀生成,继续滴加有沉淀出现,反之,将碱液滴加到硫酸盐溶液中,一开始就有白色沉淀生成,随后沉淀溶解
②互相滴加,现象相同,均产生白色沉淀
故选择①③④
(3)Al(OH)3 不能溶于弱碱:Al3++3NH3·H2O=== Al(OH)3 ↓+3NH4+
(4)可溶性锌盐与氨水反应产生的Zn(OH)2?可溶于过量氨水中,氨水的用量不易控制
本题难度:一般
3、选择题 镁粉是制备焰火的原料,工业上通过冷却镁蒸气制得镁粉.下列气体中.可以用来冷却镁蒸气的是( ? )
A.氩气
B.二氧化碳
C.氧气
D.空气
参考答案:A
本题解析:
本题难度:简单
4、选择题 常温下不能与铝反应的物质是???????? (??? )
A.硫酸铜溶液
B.烧碱溶液
C.四氧化三铁
D.稀盐酸
参考答案:C
本题解析:考查铝的性质
铝做为活泼的金属,具有较强的还原性,可与酸、碱、盐发生化学反应,高温下也可与一些氧化物发生铝热反应,例如四氧化三铁,故答案为C
本题难度:简单
5、填空题 (12分)
含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料。现有一块已知质量的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
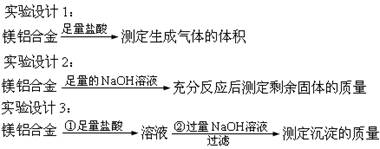
回答下列问题:
(1)上述方案中,能测出Mg的质量分数的方案是????????(填写代号,下同)
A.实验设计1?? B.实验设计2?? C.实验设计3? D.都可以
(2)上述方案中的化学反应体现了Mg、Al的性质是???????????
A.氧化性?? B.还原性?? C.酸性?? D.碱性
(3)某同学设计了右图装置。该装置适合的实验设计是???????
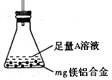

用该装置测定镁铝合金中镁的质量分数,所需的实验操作是
?????????????。
A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、干燥、称量残渣的质量
C.称量反应前后,装置和药品的总质量
(4)若按实验设计3进行实验。将m g镁铝合金,溶于过量盐酸中,再加入过量的NaOH溶液,可得到白色沉淀,该沉淀物质是?????????(填化学式);将此沉淀洗净、干燥后,称得质量为w g。求合金中镁的质量分数??????????????????;
参考答案:(1)D(2分) (2)B (2分)?(3) B (2分)?
本题解析:(1)设计(1)根据镁铝合金质量及氢气的体积可计算出结果,设计(2)铝能溶于强碱而镁不溶可知剩余的是镁,设计(3)利用Al(OH)3能溶于强碱而Mg(OH)2不溶于强碱可求解;(2)金属和酸反应或和碱反应都表现了还原性;(3)设计1需要气体收集装置,设计3第一步反应完还需要继续加NaOH溶液,所以,此装置只适用于设计2,因镁不溶于NaOH溶液,所以剩余固体即为镁;(4)因Mg(OH)2不溶于NaOH溶液Al (OH)3能溶于NaOH溶液,可知剩余的是Mg(OH)2,根据镁的物质的量等于氢氧化镁的物质的量,
本题难度:简单