微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式,正确的是
A.Ca(ClO)2溶液中通入少量SO2气体:
H2O +SO2 + Ca2+ + 2ClO— ="==" CaSO3↓+ 2HClO
B.向NH4HCO3 溶液中加入足量Ba(OH)2溶液
NH4+ +HCO3— + 2OH— ="==" H2O + CO32—+ NH3·H2O
C.向FeCl2溶液中加足量溴水
2Fe2+ + Br2 ="==" 2Fe3++ 2Br—
D.NaAlO2溶液中通入过量CO2
2AlO2— +CO2+3H2O===2Al(OH)3↓+CO32—
2、填空题 按图的装置连接好仪器,先在烧杯中加入20mL左右的Ba(OH)2溶液,接通电源后,逐渐滴加稀硫酸至过量。
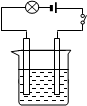
(1)当逐渐滴加稀硫酸时,烧杯中观察到的现象是: 。
(2)灯泡的现象是: ;原因是: 。
(3)发生反应的离子方程式为:
3、填空题 (10分)写出下列反应的离子方程式
(1)过氧化钠与水 ;
(2)金属铝与稀硫酸溶液 ;
(3)向Na2CO3与NaHCO3混和溶液加入CaCl2溶液 ;
(4)Al和Na的单质同时加入到一定量的水中,充分反应后,发现既无沉淀生成又无固体残留物存在,请用两个离子方程式表示有关生成H2的变化:
(A) ,
(B) 。
4、填空题 (11分)一定质量的镁、铝混合物投到2 mol·L-1的盐酸中,待金属完全溶解后,向溶液中加入2 mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。则:
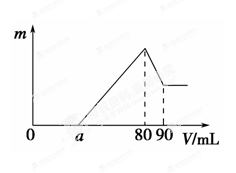
(1)80~90ml对应反应的离子方程式 。
(2)金属铝的质量为______ _
(3)盐酸的体积是 ml。
(4)a的取值范围是___ __。
(5)n(Mg)/n(Al)的最大值是 。
5、填空题 (14分)NaHSO3可被过量KIO3氧化,当NaHSO3完全消耗时即有I2析出。某课题组用淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素。
(1)写出NaHSO3溶液与过量KIO3溶液反应生成I2的离子方程式: 。
(2)调节反应物浓度和温度进行对比实验,记录结果如下:
编号
| 0.02mol/LNaHSO3溶液/mL
| 0.02mol/LKIO3溶液/mL
| H2O/mL
| 反应温度/℃
| 溶液变蓝的时间t/s
|
①
| 10
| 15
| a
| 10
| t1
|
②
| 10
| 40
| 0
| 10
| t2
|
③
| 10
| b
| 0
| 20
| t3
表中a= ,b= 。
(3)改变反应温度,重复实验③,得到温度(T)与溶液变蓝所需时间(t)的关系如下图所示(“×××”表示超过50℃后溶液不会再变蓝)。
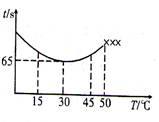
①在30℃下,若溶液变蓝时,I2的物质的量为n mol,则从反应开始至溶液变蓝,IO3-的平均反应
速率 mol·L-1·s-1(写出表达式即可,不要化简)。
②根据图像,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系: 。
(4)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设二:
假设一:反应生成的I2对反应起催化作用;
假设二: ;
………………
(5)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)。
实验方案(不要求写出具体操作过程)
| 预期实验现象和结论
|
|
|
|