微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、Fe、Cu、Zn,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转,则其可能的组合共有

A.3种
B.4种
C.5种
D.6种
参考答案:D
本题解析:
电解质是稀H2SO4时,电极可选的组合为:Cu Fe;Cu Zn;Fe Zn三种。
电解质是Fe2(SO4)3溶液时,电极可选的组合为:Cu Fe;Cu Zn;Fe Zn三种。
故选D,共6种
本题难度:简单
2、填空题 (16分)(1)在298K时,1molCH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.0 kJ。写出该反应的热化学方程式 。现有CH4和CO的混合气体0.75mol,完全燃烧后,生成CO2气体和18g液态水,并放出515kJ热量,则CH4的物质的量为 。
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入甲烷和氧气。通入甲烷气体的电极应为 极(填写“正”或“负”),该电极上发生的电极反应式为 。
(3)在下图所示实验装置中总反应的方程式为 ;
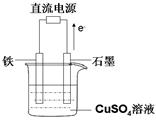
如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 ;
若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 。
参考答案: (1)CH4(g)+ 2O2(g)==CO2(g)+ 2H
本题解析:
试题分析:(1)燃烧热就是1mol物质完全燃烧生成稳定氧化物放出的热量。根据题意CH4的燃烧热化学方程式为:CH4(g)+ 2O2(g)==CO2(g)+ 2H2O(l) △H = -890.0kJ/mol,水只能由CH4燃烧生成,18g液态水的物质的量为1mol,根据反应中的计量数关系,生成1mol水需要消耗CH4物质的量为0.5mol,(2)燃料电池中燃料反应的一极是负极,发生的电极反应为CH4—8e- + 10OH- ="=" CO32- + 7H2O.(3)根据电子的移动方向知道石墨做阳极,Fe做阴极,装置就是电解CuSO4溶液,方程式为2CuSO4+2H2O 2Cu+2H2SO4+O2↑,Cu2+在阴极放电,生成铜单质,那么铁电极上附着一层红色物质,CuSO4溶液颜色变浅,Cl-在阳极放电生成Cl2,石墨电极表面有气泡产生。溶液的pH变为1则c(H+)=0.1mol/L,n(H+)=0.1mol/L×1L=0.1mol,则生成的H2SO4物质的量为0.05mol,溶液中减少了Cu和O2,相当于减少的是CuO,根据少什么就加什么,可以加入CuO,质量为0.05mol×80g/mol=4.0g,也可加入碳酸铜,质量为0.05mol×124g/mol=6.2g
2Cu+2H2SO4+O2↑,Cu2+在阴极放电,生成铜单质,那么铁电极上附着一层红色物质,CuSO4溶液颜色变浅,Cl-在阳极放电生成Cl2,石墨电极表面有气泡产生。溶液的pH变为1则c(H+)=0.1mol/L,n(H+)=0.1mol/L×1L=0.1mol,则生成的H2SO4物质的量为0.05mol,溶液中减少了Cu和O2,相当于减少的是CuO,根据少什么就加什么,可以加入CuO,质量为0.05mol×80g/mol=4.0g,也可加入碳酸铜,质量为0.05mol×124g/mol=6.2g
考点:热化学方程式的书写和计算,燃料电池电极反应的书写,电解池的有关反应方程式的书写和计算。
本题难度:一般
3、选择题 镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2
 Cd+2NiO(OH)+2H2O由此可知,该电池放电时的负极材料是 [???? ]
Cd+2NiO(OH)+2H2O由此可知,该电池放电时的负极材料是 [???? ]
A.Cd(OH)2
B.Ni(OH)2
C.Cd
D.NiO(OH)
参考答案:C
本题解析:
本题难度:简单
4、填空题 理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+ =2 Ag +Cu2+ ”设制一个化学电池(正极材料用碳棒),回答下列问题:
该电池的电解质溶液是?????;负极发生?????反应(填“氧化”或“还原”),电极反应式????????
参考答案:(1)硝酸银 ,氧化反应, Cu -2e-=Cu2+
本题解析:
试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此可知铜是负极,失去电子,凡是氧化反应,电极反应式是Cu -2e-=Cu2+。银离子在正极得到电子,因此电解质溶液应该是硝酸银溶液。
点评:该题是高考中的常见题型,属于基础性试题的考查。试题难易适中,基础性强,侧重考查学生灵活运用原电池原理解决实际问题的能力,有利于提高学生的逻辑推理能力和学习效率。该题的关键是明确原电池的工作原理,然后结合题意灵活运
本题难度:一般
5、选择题 关于下列装置说法正确的是( )
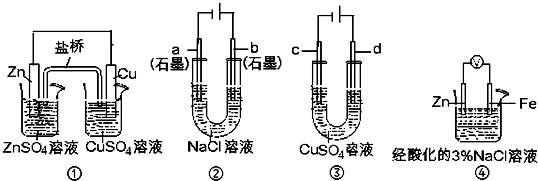
A.用装置③精炼铜时,c极为粗铜
B.装置①中,盐桥中的K+移向ZnSO4溶液
C.装置②工作一段时间后,a极附近溶液的pH增大
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成
参考答案:A、装置③精炼铜时,阳极d极应该是粗铜,阴极c极是纯铜,故A
本题解析:
本题难度:一般