微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 甲烷、甲醇、肼(N2H4)、氨和氢气等都可作为燃料电池的燃料。
(1)与甲醇互为等电子体的有机物分子式为:_________________, 甲醇的熔、沸点比甲烷的熔、沸点高,其主要原因是:______________________
(2)N2H4中N-N键键能__________(填“>”或“<” “=”) CH3CH3中C-C键键能,工业上将NH3或
(CH3)2CO与氯气反应后水解制取N2H4,(CH3)2CO中碳原子轨道的杂化类型为:_________、________,
1 mol(CH3)2CO中的π键数目为:_________。
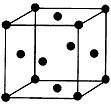
(3)用钛锰储氢合金储氢,与高压氢气钢瓶相比,具有重量轻、体积小的优点。锰原子外围电子排布式为:____________。金属钛的晶胞是面心立方结构(如图),则钛晶体的1个晶胞中钛原子数为:
________,钛原子的配位数为:________。
2、填空题 现有①NaCl??????②干冰?????③冰?????④Na2O2????⑤白磷?????⑥硫磺???⑦MgCl2????⑧金刚石?????⑨NH4NO3?????⑩SiO2十种物质,按下列要求回答:
(1)以上物质中属于原子晶体的是?????????????????????。
(2)既有离子键又有共价键的是???????????????????????。
(3)熔化时不需要破坏化学键的是?????????????????????。
3、填空题 (22分) 乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1) CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为??????;1mol O22+中含有的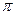 键数目为????。
键数目为????。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2,红棕色沉淀。Cu+基态核外电子排布式为??????。
(3)乙炔与氢氰酸反应可得丙烯腈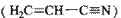 。丙烯腈分子中碳原子轨道杂化类型是??????;分子中处于同一直线上的原子数目最多为?????。
。丙烯腈分子中碳原子轨道杂化类型是??????;分子中处于同一直线上的原子数目最多为?????。
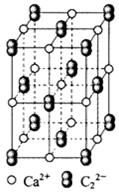
(4) CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为??????。
(5)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛高,其主要原因是????????????;甲醛分子中碳原子的轨道杂化类型为????????????。
②甲醛分子的空间构型是????????????????;1mol甲醛分子中σ键的数目为??????????。
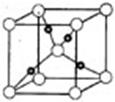
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为???????。
4、选择题 下列比较正确的是(????)
A.熔沸点:单晶硅>碳化硅>金刚石
B.熔沸点:MgO>NaCl>KCl
C.熔沸点:Na>Mg>Al
D.熔沸点:O2>I2>Hg
5、选择题 按下列四种有关性质的叙述,可能属于金属晶体的是(??? )
A.由分子间作用力结合而成,熔点很低
B.固体或熔融后易导电,熔点在1000 ℃左右
C.由共价键结合成网状晶体,熔点很高
D.固体不导电,但溶于水或熔融后能导电