微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 根据下图回答问题:
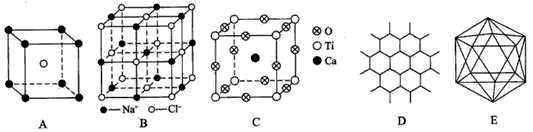
(1)A图是某离子化合物的晶胞(组成晶体的一个最小重复单位),阳离子位于中间,阴离子位于8个顶 点,该化合物中阳、阴离子的个数比是____。
(2)B图表示构成NaCl晶体的一个晶胞,通过想象与推理,可确定一个NaCl晶胞中含Na+和Cl-的个数分别为____、______。
(3)钇钡铜复合氧化物超导体有着与钙钛矿型相关的晶体结构,若Ca、Ti、O结构如C图所示的晶体,其 化学式为____。
(4)石墨晶体结构如D图所示,每一层由无数个正六边形构成,则平均每一个正六边形所占有的碳原子数为____,C-C键个数为____。
(5)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体,如E图所示。其中含有20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。试观察E图,推断这个基本结构单元所含硼原子个数、键角、B-B键的个数依次为____、____、____。
参考答案:(1) 1:1
(2)4;4
(3) CaT
本题解析:
本题难度:一般
2、选择题 氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质。下列各组物质熔化时所克服的微粒间的作用力类型与氮化硼熔化所克服的微粒间的作用力类型都相同的是
A.氯化钠和金刚石
B.金刚石和二氧化硅
C.冰和干冰
D.二氧化硫和二氧化硅
参考答案:B
本题解析:
解析:氮化硼熔化时克服的是共价键。A选项中,氯化钠和金刚石熔化时分别克服的是离子键和共价键,不一致;C选项中,冰和干冰熔化时分别克服的是氢键和分子间作用力;D选项中,二氧化硫和二氧化硅熔化时分别克服的是分子间作用力和共价键,故不正确;所以选B项。
本题难度:一般
3、填空题 1986年,瑞士两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的Nobel物理学奖。其晶胞结构如图。
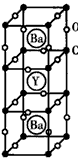
(1)根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数比,确定其化学式________________
(2)根据(1)所推出的化合物的组成,计算其中Cu原子的平均化合价(该化合物中各元素的化合价为
Y3+,Ba2+,Cu2+和Cu2+)试计算化合物中这两种价态Cu原子个数比____________________
参考答案:(1)YBa2Cu3O7
(2)Cu2+:Cu3+=2
本题解析:
本题难度:一般
4、选择题 下列说法正确的是(???)
A.熔点:金刚石>晶体硅>干冰>氯化钠晶体
B.由于HCl的分子间作用力大于HI,故HCl比HI稳定
C.等质量的金刚石和石墨晶体所含碳碳键的数目相等
D.已知AB离子晶体结构如图所示,则每个A+周围距离最近且等距的B-有8个
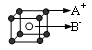
参考答案:
D
本题解析:A?错误,干冰是分子晶体,熔点比离子晶体的低。所以,熔点:金刚石>晶体硅>氯化钠晶体>干冰
B?错误,分子间作用力是决定分子晶体熔沸点的高低,并不能决定稳定性。
C?错误,金刚石是空间网状结构,石墨是片层结构,成键方式不同,所含碳碳键的数目不相等
D?正确,根据晶体结构可知,通过顶点能画8个小正方体,所以,每个A+周围距离最近且等距的B-有8个。
本题难度:简单
5、简答题 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于周期表的______区;溴的价电子排布式为______.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是______.
(3)请根据表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是______.
| 氟 | 氯 | 溴 | 碘 | 铍
第一电离能
(kJ/mol)
1681
1251
1140
1008
900
(4)已知高碘酸有两种形式,化学式分别为H5IO6(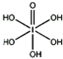 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6______HIO4.(填“>”、“<”或“=”) )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6______HIO4.(填“>”、“<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-.与KI3类似的,还有CsICl2等.已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列______式发生.
A.CsICl2=CsCl+IClB.CsICl2=CsI+Cl2
(6)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为______,写出一个ClO2-的等电子体______.
(7)已知CaF2晶体(见图)的密度为ρg?cm-3,NA为阿伏加德罗常数,最近相邻的两个Ca2+的核间距为acm,则CaF2的相对分子质量可以表示为______.
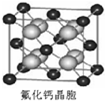
参考答案:(1)根据构造原理知,卤族元素最后填入的电子为p电子,所以卤
本题解析:
本题难度:一般
|