微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知某金属单质晶体中(如碱金属)原子堆积方式如下图所示,则该堆积方式是(?)
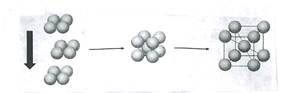
A.简单立方堆积
B.体心立方堆积
C.六方最密堆积
D.面心立方最密堆积
参考答案:B
本题解析:从图中可以看出,立方体的八个顶点上有原子,在立方体的中心也有,故为体心立方堆积。
本题难度:一般
2、选择题 最近发现一种钛原子和碳原子构成的气态团簇分子,如图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为
 [???? ]
[???? ]
A.Ti14C13
B.TiC
C.Ti4C4
D.Ti4C3
参考答案:A
本题解析:
本题难度:一般
3、选择题 下列叙述正确的是(??? )
A.胶体溶液的电泳现象说明胶体带电荷
B.含有非极性键的化合物一定为共价化合物
C.原子晶体中共价键越强其熔点越高,如晶体硅比Si02熔点高
D.含有阴离子的物质必然含有阳离子.但含有阳离子的物质不一定含有阴离子
参考答案:D
本题解析:略
本题难度:简单
4、选择题 下面的排序不正确的是
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF> NaCl> NaBr>NaI
参考答案:C
本题解析:
试题分析:晶体熔沸点高低比较的一般规律是:原子晶体,熔沸点大小和共价键的强弱有关系;金属晶体中,形成金属键的金属阳离子半径越小,电荷数越多,金属键越强,熔沸点越高;分子晶体中形成分子晶体的分子间作用力越大,熔沸点越高;离子晶体中形成离子键的离子半径越小,电荷数越多,离子键越强,熔沸点越高。A中都是分子晶体,B中都是原子晶体,D中都是离子晶体,其熔点大小顺序是正确的;C中是金属晶体,熔点等闲视之应该是Na<Mg<Al,答案选C。
点评:该题是高考中的常见题型和考点,属于中等难度的试题。试题基础
本题难度:简单
5、选择题 纳米材料的表面微粒数占总微粒数的比例极大,这是它具有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状(如图所示)相同,则这种纳米颗粒的表面微粒数占总微粒数的百分数为
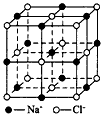 [???? ]
[???? ]
A. 87.5%
B. 92.9%
C. 96.3%
D. 100%
参考答案:C
本题解析:
本题难度:一般