微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)铅蓄电池是可充电型电池,它的正负极极板是惰性材料,电池总反应式为:
参考答案:
本题解析:
本题难度:一般
2、选择题 电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是(????)
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池的正极反应为O2+4e-+2H2O=4OH-
C.氢氧燃料电池工作时氢气在负极被氧化
D.铅蓄电池的正极发生的反应是 Pb(s) - 2e—+SO42—(aq)= PbSO4(s)
参考答案:C
本题解析:A不正确,锌锰干电池中碳棒是正极,氢离子得到电子,A不正确。B不正确,因为电解质不一定是碱性溶液。原电池中负极失去电子,被氧化,所以氢气在负极通入,C正确。原电池中正极得到电子,D不正确,答案选C。
本题难度:简单
3、填空题 (12分)生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式______________。
(2)根据等电子原理,写出CO分子的结构式________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9 。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,若Na2CO3溶液的浓度为2×10—4mo1/L,现将等体积的CaCl2溶液与Na2CO3溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为______mo1/ L。
(4)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是________;甲醛分子的空间构型是_____,中心碳原子的轨道杂化类型为_____。1 mol甲醛分子中σ键的数目为________。
②甲醇可制作燃料电池,以KOH溶液作电解质,向两极分别充入甲醇和空气,工作过程中,负极反应方程式为:___________________。
③已知在常温常压下:
CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H=" -359.8" kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ? △H=" -556.0" kJ·mol-1
H2O(g)=H2O(l)? △H=" -44.0" kJ·mol-1
写出体现甲醇燃烧热的热化学方程式 。
参考答案:(1)1s22s22p63s23p63d104s2
(
本题解析:
试题分析:(1)Zn的原子序数为30,关键是要注意3d轨道写在4s轨道的前面,电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2,(2)依据等电子原理,可知CO与N2为等电子体,N2分子的结构式为:N≡N,互为等电子体分子的结构相似,可写出CO的结构式为C≡O,故答案为:C≡O;
(3)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1/2×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)×c(Ca2+)=2.8×10-9可知,c(Ca2+)=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L.
(4)①甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸
点高;甲醛为sp2杂化,不含孤电子对,分子的空间构型为平面三角形;1mol甲醛分子中含有2mol碳
氢δ键,1mol碳氧δ键,故含有δ键的物质的量为3mol,数目为1.806×1024个;②正极得到电子,
发生还原反应,同时因为在碱性条件下,则OH-参与反应,根据总方程式可知产物是CO32-和6H2O所以答案为:CH3OH-6e-+8OH-=CO32-+6H2O③根据盖斯定律得 :热方程式1+热化学方程式2×1/2+热化学方程式3×2 则答案为CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol
考点:考查共价键类型和热化学方程式书写等相关知识点
本题难度:困难
4、选择题 一种新型绿色电池—燃料电池,是把H2、CO、CH4气体和空气不断输入直接氧化,使化学能转变为电能,它被称为21世纪的绿色发电站,这三种气体可以作为燃料电池所需燃料的理由是
A.都是无毒无害气体
B.在自然界都大量存在
C.都可以燃烧并放出大量的热
D.燃烧产物均为CO2和H2O
参考答案:C
本题解析:三种物质都是可燃性气体,燃烧发出大量的热,这是这三种气体可以作为燃料电池所需燃料的关键,C正确,CO有毒,A不正确。B不正确,自然界氢气和CO不是大量存在的,CO的燃烧产物没有水,氢气的 生成物没有CO2,D不正确,答案选C。
本题难度:简单
5、填空题 (共10分前2个空每空一个1分,其余每空2分)依据氧化还原反应2Ag+(aq)+Cu(s) ="===" Cu2+(aq)+2Ag(s)设计的原电池如图所示:
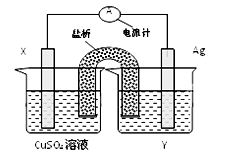
请回答下列问题:
(1)外电路中的电子是从_______ 电极流向________电极。
(2)银电极发生的电极反应为________________________;
X电极上发生的电极反应为___________________________;
(3)LiSOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOCl2==="4LiCl" +S +SO2↑。请回答下列问题:
写出电池的负极发生的电极反应为_________________________________________;
电池正极发生的电极反应为______________________________________;
参考答案:(1)X Ag; (2)A
本题解析:
试题分析:(1)该原电池中,铜是负极,银是正极,外电路中的电子从负极流向正极,即从X电极沿导线流向银电极;
(2)银电极上得到电子发生还原反应,电极反应式为Ag+ e-=Ag,
铜电极上铜失去电子发生氧化反应,电极反应式为Cu-2e-=Cu2+;
(3)由总反应可知,该原电池中Li被氧化,应为原电池负极反应,电极反应式为Li-e-=Li+,
SOCl2在正极得电子被还原生成S,同时有生成SO2,电极反应为2SOCl2+4e-=4Cl-+S+SO2,
考点:考查原电池的工作原理、化学电源
点评:本题考查了原电池的工作原理、化学电源,难度不大。在学习过程中要熟练掌握原电池的工作原理,并会根据实际的反应、化合价的变化等推断出电极反应式。
本题难度:一般