微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质在常温下可用铁质容器盛放的是
A.亚硫酸
B.浓硫酸
C.浓盐酸
D.胆矾溶液
参考答案:B
本题解析:略
本题难度:简单
2、填空题 以黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)为原料炼铜的方法分为高温炼铜和湿法炼铜两种。近年来,湿法炼铜有了新进展,科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐:4CuFeS2+2H2SO4+17O2 4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下:
4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下:

回答下列问题:
(1)下列物质中可以用于上述流程中调节溶液pH的是 (填序号)。
A.Cu;
B.Cu2(OH)2CO3;
C.H2SO4;
D.Fe;E.CuO
(2)滤渣A的主要成分为 ????????????????????(写化学式)。
(3)写出反应Ⅰ的化学方程式: ????????????????????。
(4)试剂a为 ????????????????????????????? 。
(5)欲从溶液中获得绿矾晶体,分离操作Ⅰ应为 (写操作名称)。
(6)生产过程中,除了试剂a、H2O可以循环使用外,还可循环使用的物质有 (写化学式)。
参考答案:(1)BE
(2)Fe(OH)3
(3)2CuS
本题解析:(1)流程图中的混合溶液为CuSO4和Fe2(SO4)3。调节pH的目的是除去Fe3+,Fe3+水解的方程式为:Fe3++3H2O Fe(OH)3+3H+。要求加入的试剂能与H+反应,不能引入除Cu2+、Fe3+外的其他杂质离子,不能与Fe3+反应,故供选试剂中只有B、E适合。(3)电解CuSO4溶液,其产物为C
Fe(OH)3+3H+。要求加入的试剂能与H+反应,不能引入除Cu2+、Fe3+外的其他杂质离子,不能与Fe3+反应,故供选试剂中只有B、E适合。(3)电解CuSO4溶液,其产物为C
本题难度:困难
3、填空题 现有Fe、Cu组成的合金,其中Cu、Fe的总物质的量为a mol,Cu的物质的量分数为x;研成粉末后,全部投入含b mol HNO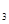 的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
(1)若剩余的残渣只有Cu,则溶液中含有的金属离子为__________。(写出所有可能情况)
(2)当溶液中金属离子只有Fe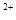 、Cu
、Cu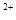 时,则b的取值范围是(用a、x表示)___________。
时,则b的取值范围是(用a、x表示)___________。
(3)当x=0.5,溶液中Fe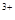 与Fe
与Fe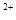 的物质的量相等时,在标准状况下共产生672 mL气体。则a=____________、b=_____________。
的物质的量相等时,在标准状况下共产生672 mL气体。则a=____________、b=_____________。
参考答案:(1)? Fe2+或Fe2+、Cu2+ (2分)
(2
本题解析:
试题分析:(1) Cu、Fe的混合物与稀硝酸反应,金属可能有剩余,可能没有剩余.金属可能有剩余时,根据共存可知,剩余金属有两种情况:
①剩余Fe、Cu,当有Fe剩余时,溶液中能与Fe反应的Fe3+、Cu2+都不存在,所以溶液中只有Fe2+;
②只剩余Cu,溶液中一定不存在与Cu反应的Fe3+,根据离子共存,溶液可能只有Fe2+;
③通过②知,溶液中还可能存在的离子是Fe2+、Cu2+;
④当固体没有剩余时,可能存在的情况是:当Fe恰好与硝酸反应生成Fe2+,Cu恰好与硝酸生
本题难度:一般
4、选择题 证明某溶液只含有Fe2+而不含有Fe3+的实验方法是 (?? )
A.先滴加氯水,再滴加KSCN溶液后显红
B.只需滴加KSCN溶液
C.先滴加KSCN溶液,不显红色,再滴加氯水后显红色
D.加Na2O2固体后观察沉淀颜色的变化
参考答案:C
本题解析:
试题分析:证明不含Fe3+可加KSCN溶液,溶液不显红色,再证明含有Fe2+,只需加入合适的氧化剂(如氯水),溶液变为血红色。若向溶液中加过氧化钠固体后最终产生红褐色沉淀,不能证明只有Fe2+而没有Fe3+。
点评:检验Fe2+离子的方法是先加KSCN溶液无现象,再加少量氯水,溶液变为血红色。
本题难度:一般
5、实验题 在化学分析中,为了测定某试样中FeSO4·7H2O的质量分数,一般采用在酸性条件下用高锰酸钾标准溶液滴定的方法,反应原理为:5Fe2++8H++MnO4- 5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+
5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+ 10CO2↑+2Mn2++8H2O。
10CO2↑+2Mn2++8H2O。
实验步骤如下:
步骤一:先粗配浓度约为1.5×10-2mol·L-1的高锰酸钾溶液500 mL。
步骤二:称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用(1)所配高锰酸钾溶液进行滴定,从而可标定高锰酸钾溶液的浓度。经测定,c(KMnO4)=0.0160 mol·L-1
步骤三:称取FeSO4·7H2O试样1.073g,放入锥形瓶中,加入适量的水溶解,
步骤四:用标准高锰酸钾溶液滴定步骤三所配样品溶液,达到终点时消耗标准溶液48.00mL。
试回答下列问题:
(1)步骤一中要用到的玻璃仪器是烧杯、___________??、?????????????????。
(2)步骤二中需要对m的大致值进行预估,你预估的依据是????????????????????????????
___________________________________________________????????????????????????????。
(3)本实验中操作滴定管的以下图示,正确的是______________(填编号)。

(4)步骤二的滴定是在一定温度下进行的,操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢。试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是????????????______________________????????????????????????????????。
(5)请在下面空白处设计步骤四中的数据记录和数据处理表格(不必填数据)。
(6)国家标准规定FeSO4·7H2O的含量(w):一级品100.5%≥w≥99.50%;二级品? 100.5%≥w ≥99.00%;三级品? 101.0%≥w≥98.00%。试判断该试样符合国家________级品标准。
(7)测定试样中FeSO4·7H2O的含量时,有时测定值会超过100%,其原因可能是???????????
_______________________________________________??????????????????????????????。
参考答案:(1)量筒、玻璃棒(少答或多答“容量瓶”不给分)(2分)
本题解析:(1)由于是粗配,不需要用容量瓶,只要用烧杯,量筒这些粗量器即可.
(2)该步要求由根据KMnO4的用量及反应的反应的定量关系来算Na2C2O4固体用量,现在KMnO4溶液浓度已知,需要知道它的体积,而体积的最大值就是滴定管的最大容量.
(3)酸性KMnO4溶液必须用酸式滴定管盛装滴定.
(4)反应速度骤然增大往往是由于催化剂\或升温\或加压(对气体参与的反应有效),该题所涉及的反应物产物为非气体,而且是在一定温度下进行的,所以最有可能是催化剂所致
(5)见上图
(6)FeS
本题难度:一般