微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某同学应用如下所示装置研究物质的性质。其中气体C的主要成 分是氯气,还含有少量空气和水蒸气。请回答下列问题:

(1)该项研究的主要目的是探究氯气与水反应后生成的物质具有??????性。?
(2)浓硫酸的作用是???????????????????。
(3)观察到的实验现象是B中??????????????????,C中????????????????????????????。
(4)从物质性质方面来看,这样的实验设计还存在事故隐患,事故表现在???????????????????。要克服该事故隐患,选择的操作是下图的??????,
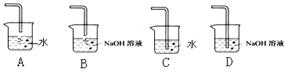
?并写出与解决隐患相关的离子方程式表示(1分):???????????????????????。
参考答案:(7分)(1)漂白性 (2)吸收气体A中的水?
(3)
本题解析:
试题分析:(1)根据装置中有干燥的有色布条可知,该项研究的主要目的是探究氯气与水反应后生成的物质具有漂泊性的。
(2)由于氯气中含有水蒸气,所以浓硫酸的作用就是吸收气体A中的水,防止干扰实验。
(3)由于真正起漂白作用的是氯气和水反应生成的次氯酸,所以实验现象就是B中干燥的布条不褪色,而C中湿润的布条褪色。
(4)由于氯气有毒,随意排放会造成环境污染,所以该实验装置还缺少尾气处理装置。吸收氯气一般用氢氧化钠溶液,显然装置D更合理,有关反应的离子方程式是Cl2 + 2OH- = Cl- + ClO- + H2O。
点评:该题是中等难度的试题,试题注重基础,侧重能力的培养和解题方法的训练,有利于培养学生的逻辑思维能力,提高学生的规范实验设计,也有助于提高学生分析问题、以及灵活运用基础知识解决实际问题的能力。
本题难度:一般
2、实验题 (14分)实验是进行化学研究的重要手段之一。请完成下列问题。
(1)下面A~E是中学化学实验中常见的几种实验装置。
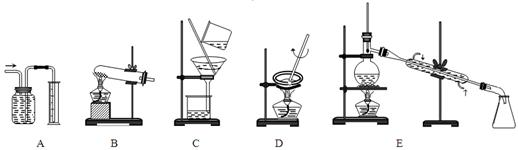
请为进行下列实验挑选合适的装置(填序号字母)
①量气装置是?????????????????;②过滤装置是?????????????????;
③蒸发装置是?????????????????;④I2的CCl4溶液中提取I2选用?????????????????。
(2)下列实验操作,不正确的是________
a.用纸槽往试管里装粉末状药品时,试管应先横放再直立
b.称取氢氧化钠固体时,应将氢氧化钠固体直接放在左边托盘内,右边托盘放砝码
c.试管、烧杯、量筒、集气瓶都不能用酒精灯直接加热
d.用试纸检验气体性质时,手拿着试纸经水润洗后靠近气体观察试纸颜色的变化
(3)实验室需要450 mL 0.1 mol/LNaOH溶液和500 mL 0.5 mol/L硫酸溶液。请回答下列问题。
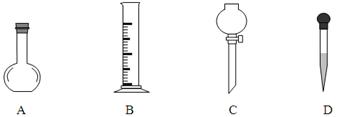
①在下图所示仪器中,配制上述溶液肯定不需要的是?????????????????,(填序号)除图中已有仪器外,配制上述溶液还需要的玻璃仪器有?????????????????。
②配制450 mL 0.1 mol/L NaOH溶液的实验步骤如下:
a.计算应称取氢氧化钠固体的质量为?????????????????g。
b.称量氢氧化钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶。
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却。
e.盖好瓶塞,反复上下颠倒,摇匀。
f.继续向容量瓶中加蒸馏水至刻度线下1~2 cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切。
上述步骤的正确操作顺序为?????????????????。(填序号)
参考答案:(14分)
(1)A(1分)?? C(1分)?? D(
本题解析:
试题分析:
(1)A装置是排水量气装置,B装置是固体加热反应装置,C装置是过滤装置,D装置是蒸发液体装置,E装置是蒸馏装置。
(2)因为氢氧化钠具有腐蚀性和易潮解性质,称量时应该放入小烧杯或表面皿中称量;量筒不能加热、试管可以直接加热;试纸应该用镊子夹住靠近气体,不能用手直接去拿试纸。
(3)配制氢氧化钠和硫酸需要用到托盘天平、量筒、500 mL容量瓶、滤纸、烧杯、玻璃棒、胶头滴管等仪器,不需要平底烧瓶和分液漏斗,还缺少烧杯、玻璃棒、500 mL容量瓶;根据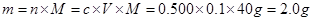 ,不能用450mL的体积来计算,因为没有这个容积的容量瓶。根据溶液配制的步骤:一算(计算)、二称(称量)、三溶(溶解)、四转(转移)、五洗(洗涤)、六定(定容)、七摇(摇匀)、八装(装瓶)、九贴(贴标签)。应该是abdcfe。
,不能用450mL的体积来计算,因为没有这个容积的容量瓶。根据溶液配制的步骤:一算(计算)、二称(称量)、三溶(溶解)、四转(转移)、五洗(洗涤)、六定(定容)、七摇(摇匀)、八装(装瓶)、九贴(贴标签)。应该是abdcfe。
点评:实验是学生答题易失分点,虽然本题属于基础题,但对于学生仍然是难点。
本题难度:一般
3、选择题 以下集气装置中正确的是 (?????)???????
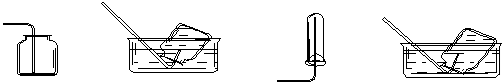
A.CO2的收集
B.NO的收集
C.O2的收集
D.NH3的收集
(液体为H2O)????????????????????????????(液体为H2O)
参考答案:AB
本题解析:
试题分析:CO2的密度大于空气的,所以应该用向上排空气法收集,A正确;NO极易被氧化生成NO2,所以只能用排水法收集,B正确;O2的密度大于空气的,所以应该用向上排空气法收集,C正确;氨气极易溶于水,应该用向下排空气法收集,D不正确,答案选AB。
点评:常见气体的收集方法是:1.排水法,适用于不易溶于水的气体。例如氢气,氧气;2.向上排空气法,适用于比空气密度大,溶于水的气体,例如二氧化碳,氯气;3,向下排空气法,适用于比空气密度小,溶于水的气体,例如氨气。
本题难度:一般
4、实验题
5 Fe2+ +5C2O42—+3MnO4—+24H+="=5" Fe3+ +10CO2↑+3Mn2++12H2O
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b mL
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5—8min,经检验溶液合格后,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c mL
③????????????????????????????????????。
④数据处理。
请回答下列问题:
(1)上述实验方案中的步骤③是?????????????????????????????????????????。
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ、检验活塞是否漏水。
Ⅱ、??????????????????????????????????????????????????????????????????。
Ⅲ、加入高锰酸钾标准溶液,赶走尖嘴部位的气泡,调节起始读数。
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有?????????溶液的试管中,如????????????,则说明溶液合格。
(4)某小组的一次测定数据记录如下:
a/g
| 起始读数/mL
| b/mL
| c/mL
|
0.1970
| 0.00
| 31.30
| 42.40
根据数据计算0.1970g 样品中:n(Fe2+)==????????; n(C2O42—)==????????;
FeC2O4的质量分数为??????????????(精确到0.01%)
参考答案:(1)重复以上实验1—2次(2分)
(2)用高锰酸钾标
本题解析:(1)中和滴定实验为减少实验误差,一般要重复进行2-3次,取其平均值进行计算,这样可以减少误差,故步骤③也应该是再重复实验1-2次;(2)中和滴定操作的一般步骤是先检验活塞是否漏水,再洗涤,洗涤要先用蒸馏水洗,然后用待装的溶液润洗,以保证待装溶液的浓度不会被蒸馏水冲稀了,故这里要用待装的高锰酸钾标准溶液润洗滴定管;(3)加入锌粉和稀硫酸的目的是使铁离子还原成亚铁离子,所以是否合格的标准当然是看有无铁离子存在,没有铁离子存在即合格,否则就不合格,而检验铁离子的最好方法是加硫氰化钾,若溶液不变红,说明没有了铁离子,即合格;(4)设溶液中亚铁离子的物质的量为n1,草酸根离子的物质的量为n2,即有下列关系:
5Fe2+——————————MnO4—
5?????????????????????? 1
n1????????? (42.40-31.30)mL×10—3L/mL×0.02000mol/L
n1=0.001110mol
5C2O42———————————2MnO4—
5?????????????????????????? 2
n2?????????? (0.03130—0.01110)
n2=0.001010mol
w(FeC2O4)=0.001010mol×144g/mol÷0.1970g=73.81%
本题难度:一般
5、填空题 (2014届上海市十三校高三测试化学试卷)
二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂。
方法一:氯化钠电解法是一种可靠的工业生产ClO2气体的方法。该法工艺原理如图。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
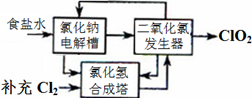
(1)工艺中可利用的单质有__________(填化学式),发生器中生成ClO2的化学方程式为_____________。
(2)此法的缺点主要是______________________________________。
方法二:最近,科学家又研究出了一种新的制备方法,纤维素还原法制ClO2,其原理是:纤维素水解得到的最终产物X与NaClO3反应生成ClO2。
(3)配平方程式: □ (X) +□NaClO3+□H2SO4→□ClO2↑+□CO2↑+□H2O+□______
若反应中产生4.48L(折算成标准状况下)气体,电子转移________ 个。
(4)ClO2和Cl2均能将电镀废水中的CN—氧化为无毒的物质,自身被还原为Cl—。处理含CN—相同量的电镀废水,所需Cl2的物质的量是ClO2的_______倍。
方法三:实验室常用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,化学反应方程式为:2NaClO3+Na2SO3+H2SO4 2ClO2↑+2Na2SO4+H2O 2ClO2↑+2Na2SO4+H2O
(5)反应中的Na2SO3溶液中存在如下平衡:H2O H++OH-和 ________________(用离子方程式表示). H++OH-和 ________________(用离子方程式表示).
常温下,0.1mol/L该溶液中离子浓度由大到小排列__________________(用离子符号表示)
(6)常温下,已知NaHSO3溶液呈酸性,在Na2SO3溶液中滴加稀盐酸至中性时,溶质的主要成分有________________。(用化学式表示)
参考答案:
(1)H2、Cl2??????2NaClO3+ 4H
本题解析:
(1)有工艺流程图可以看出:在该工艺中可利用的单质有H2、Cl2?。根据流程图、质量守恒定律及电子守恒规律可得出在发生器中生成ClO2的化学方程式为: 2NaClO3+ 4HCl=2ClO2↑+Cl2↑+ 2NaCl + 2H2O
(2)由 制备原理和流程图可知此法的缺点主要是会产生大量的Cl2,消耗大量的电能,产物ClO2和Cl2不仅不容易分离,而且物质利用率低,很容易造成大气污染。
(3)纤维素水解得到的最终产物X是葡萄糖C6H12O6。它与NaClO3在酸性条件下发生反应,根据质量守恒定律和电子守恒的知识可得方程式为1C6H12O6+24NaClO3+12H2SO 4→24ClO2↑+6CO2↑ +18H2O+ 12Na2SO4,由方程式可以看出每产生30mol的气体,转移电子24NA。现在产生气体颚物质的量为4.48L ÷22.4L/mol=0.2mol。所以转移电子的物质的量为24NA÷30×0.2="0.16" NA
(4)处理含CN—相同量的电镀废水,即转移电子的物质的量相同。假设转移电子2mol,则需要Cl2的物质的量是1mol;需要ClO2的物质的量为2÷=0.4mol。所以n(Cl2): n(ClO2)=1:0.4=2.5。
(5)反应中的Na2SO3溶液中存在如下平衡:H2O H++OH-和SO32-的水解平衡的两种方程式。由于SO32-是二元弱酸的酸根离子,因此存在两步水解平衡SO32- +H2O H++OH-和SO32-的水解平衡的两种方程式。由于SO32-是二元弱酸的酸根离子,因此存在两步水解平衡SO32- +H2O  OH-+HSO3-, HSO3- +H2O OH-+HSO3-, HSO3- +H2O  OH-+H2SO3。Na2SO3=2Na++ SO32-;c(Na+)>c(SO32-).SO32-水解产生OH-和HSO3-,HSO3-进一步水解还要消耗HSO3-,同时产生OH-,因此c(OH-)>c(HSO3-).在溶液中还存在水的电量平衡,所以c(HSO3-)>c(H+).在溶液中盐水解的程度是很微弱的,所以c(SO32-)> c(OH-)。因此在该溶液中各种离子的浓度由大到小的顺序为c(Na+)>c(SO32-)> c(OH-)>c(HSO3-)>c(H+)。 OH-+H2SO3。Na2SO3=2Na++ SO32-;c(Na+)>c(SO32-).SO32-水解产生OH-和HSO3-,HSO3-进一步水解还要消耗HSO3-,同时产生OH-,因此c(OH-)>c(HSO3-).在溶液中还存在水的电量平衡,所以c(HSO3-)>c(H+).在溶液中盐水解的程度是很微弱的,所以c(SO32-)> c(OH-)。因此在该溶液中各种离子的浓度由大到小的顺序为c(Na+)>c(SO32-)> c(OH-)>c(HSO3-)>c(H+)。
(6)在Na2SO3溶液中滴加稀盐酸若恰好发生反应:Na2SO3+HCl=NaCl+NaHSO3。则由于NaHSO3溶液呈酸性。所以至中性时,n(HCl)<n(Na2SO3).产生溶液中含有的溶质有未反应的Na2SO3及反应生成的NaCl、NaHSO3。溶质有Na2SO3、NaCl、NaHSO3。也可能滴加HCl局部过量会产生SO2、H2SO3溶解在该溶液中还含有SO2和H2SO3。
本题难度:一般
|