微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组物质中,常温下能起反应产生气体的是
A.铜跟稀硫酸
B.铁跟浓硫酸
C.铝跟浓硝酸
D.铜跟浓硝酸
参考答案:D
本题解析:A不反应,B、C均发生钝化,D+Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O,反应酸性NO2,答案选D。
本题难度:一般
2、选择题 在氯化钡溶液中通入SO2,溶液仍澄清,若将氯化钡溶液分装入两试管中,一支通氯气,另一支加烧碱溶液,然后再通入SO2,结果两试管都有有白色沉淀。由此得出的下列结论合理的是(??)
A.氯化钡具有两性
B.SO2有还原性和酸性
C.两支试管内白色沉淀均是亚硫酸钡
D.氯化钡溶液中通入SO2后溶液仍澄清的原因是由于SO2过量,生成了亚硫酸氢钡
参考答案:B
本题解析:略
本题难度:简单
3、选择题 为了除去SO2中的SO3,以制得纯的SO2,下列试剂最好选用(??? )
A.石灰水
B.饱和NaHSO3
C.浓H2SO4(98.3%)
D.饱和Na2SO3溶液
参考答案:BC
本题解析:A项,石灰水与SO3、SO2均反应;B项,2NaHSO3+SO3 Na2SO4+H2O+2SO2↑;C项,H2SO4(浓)+xSO3
Na2SO4+H2O+2SO2↑;C项,H2SO4(浓)+xSO3 本题难度:简单
本题难度:简单
4、实验题 分析下图装置,回答问题:
(1)装置A的烧瓶中发生的反应的化学方程式为????????????????,??
(2)装置C的直玻管中发生的反应的化学方程式为?????????????????????,
(3)在装置D的U形管中有无色晶体生成,此晶体的化学式是????????,
(4)装置E中NaOH的作用是????????????????,反应的离子方程式为???????????????;
(5)B装置的作用很多,除了可以混匀气体外,
还可以:____________________;?? __________________________________。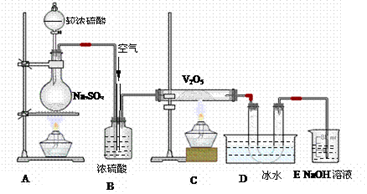
参考答案:(1)Na2SO3+H2SO4=Na2SO4+H2O+SO2
本题解析:
试题分析:该实验装置图为在A产生了二氧化硫,气体在B中被干燥,然后二氧化硫和氧气在五氧化二钒催化加热下生成了三氧化硫,三氧化硫的凝固点很低,在D中被凝结,E为除去还没有反应的二氧化硫,所以(1)装置A的烧瓶中发生的反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+H2O+SO2,(2)装置C的直玻管中发生的反应的化学方程式为:2SO2+O2==2SO3,(3)在装置D的U形管中有无色晶体生成,此晶体的化学式是SO3;(4)装置E中NaOH的作用是吸收尾气,其反应的离子方程式为SO2+2O
本题难度:一般
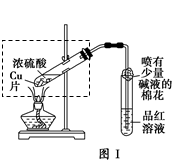
5、实验题 某校化学兴趣小组在探究铁与浓硫酸的反应时,将教材中铜与浓硫酸反应的实验装置(图Ⅰ)改为下图Ⅱ所示的装置。
 ???
???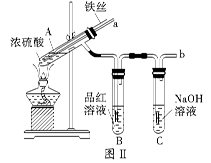
请回答下列问题:
(1)写出图Ⅰ中虚框处发生反应的化学方程式_________。
(2)图Ⅱ实验装置与图Ⅰ相比较,其优点是:①能更好地吸收有毒气体SO2,防止其污染环境;②_________。
(3)下列对导管a的作用分析中正确的是_________ (填字母)。
A.加热反应过程中,可上下移动导管a,起搅拌作用
B.停止加热,试管内的压强减小,从导管a进入的空气可增大试管A内的压强,防止倒吸
C.停止反应,撤装置之前往导管a中通入空气,可排除装置内的SO2气体,防止其污染环境
(4)反应一段时间后,将试管A取下,然后将试管A中溶液倒入另一盛有适量水的试管D中。该小组同学为确定溶液中所存在的金属离子,进行下列探究过程。
①提出假设:
假设Ⅰ:只含有Fe3+。假设Ⅱ:_________。假设Ⅲ:_________。
②实验设计:
分别取少量试管D中溶液,选用提供的试剂,设计简单的实验检验溶液中所存在的金属离子。请填写下表空白(可以不填满,也可以增加)。
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液。
步骤
| 所选试剂
| 现象及结论
|
1
| ?
| ?
|
2
| ?
| ?
|
3
| ?
| ?
?
参考答案:(共12分)
(1)Cu+2H2SO4(浓)
本题解析:
试题分析:
(2)铁丝可进可出,便于控制反应的进行。
(3)铁丝可进出,起到搅拌的作用,玻璃导管没有搅拌作用。A错,选BC。
(4) ①若硫酸过量,得Fe3+;铁过量,得Fe2+;若过量一部分,同时含有Fe2+和Fe3+。
②Fe3+和KSCN溶液反应,溶液变红;Fe2+遇KSCN溶液不变红,加KMnO4溶液后,变红。
本题难度:困难
|