微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 1.2 mol氯气与元素A的单质完全反应生成0.8 mol的氯化物AClx,则x值为…()
A.1
B.2
C.3
D.4
参考答案:C
本题解析:解法一:根据方程式计算
2A+xCl2 2AClx
2AClx
x mol ???????2 mol
1.2 mol?????? 0.8 mol
x=3
解法二:根据氧化还原反应得失电子总数相等关系求解
设A的化合价为x,
则A
本题难度:简单
2、选择题 NA为阿伏加德罗常数,下列说法正确的是?(????)??????????????????
A.标准状况下,11.2 L的己烷所含的分子数为0.5 NA
B.28 g乙烯所含共用电子对数目为4 NA
C.0.1molCnH2n+2中含有的C-C键数为0.1n NA
D.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA
参考答案:D
本题解析:标准状况下己烷不是气体,是液体,A不正确。根据乙烯的结构简式可知,乙烯中含有的共用电子对数目是6对,B不正确。根据通式可知C中有机物是烷烃,烷烃是链烃,含有的C-C单键是n-1个,C不正确。乙烯和丙烯都属于烯烃,最简式相同,都是CH2,所以2.8g含有的碳原子是 ,所以D正确。答案选D。
,所以D正确。答案选D。
本题难度:一般
3、选择题 将KClO3、I2各0.02 mol加入12 g 36.5%的盐酸中,I2恰好完全溶解,没有气体产生(不考虑盐酸的挥发)。将反应后的溶液用冰水冷却,析出橙红色晶体A(A在常温下就有升华现象),过滤,将滤液蒸干,收集到KCl固体、8.7g液态水和极少量的A蒸气。则A的化学式可能是
A.I2Cl6
B.HClO
C.IClO
D.KIO3
参考答案:A
本题解析:
试题分析:橙红色晶体A在常温下就有升华现象,是共价化合物,不含钾元素,根据K元素守恒,可知最终收集的KCl为0.02mol,根据质量守恒,可知A的质量=12g+0.02mol×122.5g/mol+0.02mol×254g/mol-8.7g-0.02mol×74.5g/mol=9.34g。根据Cl原子守恒,可知A中n(Cl)=0.02mol+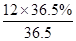 本题难度:一般
本题难度:一般
4、选择题 在托盘天平的两盘中各放入同浓度同体积的足量稀硫酸,分别加入0.1mol两种金属,反应后需在游码中拔动0.2个大格后,天平才能恢复平衡。两金属是(?)
A.镁和铝
B.铁和铝
C.镁和钠
D.铁和铜
参考答案:A
本题解析:反应后需在游码中拔动0.2个大格后,天平才能恢复平衡,说明质量相差0.2g。根据金属和硫酸反应的方程式可知,选项A正确,BCD分别相差3.0g、0、1.0g,答案选A。
本题难度:一般
5、简答题 某化学实验室需要0.2mol/LNaOH溶液500mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器是______(填仪器名称).
(2)容量瓶是配制溶液的主要仪器,容量瓶上标有以下六项中的______(填写序号).
①温度②浓度③容量④压强⑤酸式或碱式⑥刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)______.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约50mL),用玻璃棒慢慢搅动,使其充分溶解,冷却到室温
C.将容量瓶盖紧,摇匀
D.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
E.改 用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为:______mL(计算结果保留一位小数).
(5)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是:______.
(6)将所配制的稀H2SO4进行测定,发现实际浓度小于0.5mol/L.请你分析下列哪些操作会引起所配浓度偏小(填写字母)______.
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.烧杯未进行洗涤
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
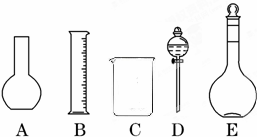
参考答案:(1)A为平底烧瓶、D为分液漏斗,在配制溶液过程中不会使用到
本题解析:
本题难度:一般