微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将23g?Na和24g?Mg分别投入等质量的过量的盐酸中,反应完毕后,所得溶液的质量分数分别为m和n,则m和n的关系是( )
A.m>n
B.m=n
C.m<n
D.无法确定
参考答案:金属完全反应,23g?Na的物质的量为1mol,生成氢气0.
本题解析:
本题难度:简单
2、简答题 32g?Cu与一定量的浓硫酸加热后,恰好完全反应,反应方程式如下:Cu+2H2SO4
??△??
.
?
CuSO4+SO2↑+2H2O
问:(1)得到SO2气体的体积(标准状况下)是多少?
(2)把所得的CuSO4?配制成250mL?CuSO4溶液,所得溶液中溶质的物质的量浓度.
参考答案:n(Cu)=32g
本题解析:
本题难度:一般
3、选择题 相同物质的量的镁和铝分别与足量的盐酸反应,所生成的氢气在标准状况下的体积比是( )
A.1:1
B.3:2
C.2:3
D.8:9
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列化学表述正确的是
A.氯化钠的晶体模型:
B.铍原子最外层的电子云图:
C.次氯酸的结构式:H-O-Cl
D.CH3CHOHCH(CH3)2名称:2-3-二甲基丙醇
参考答案:C
本题解析:
试题分析:A、氯化钠的晶体模型是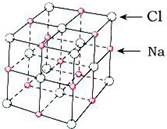 ,A不正确;B、铍原子最外层的电子是2s2,所以电子云是球形对称的,B不正确;C、次氯酸中氧元素的化合价是-2价,氢元素和氯元素均是+1价,所以结构式是H-O-Cl,C正确;D、CH3CHOHCH(CH3)2名称是3-甲基-2-丁醇,D不正确,答案选C。 ,A不正确;B、铍原子最外层的电子是2s2,所以电子云是球形对称的,B不正确;C、次氯酸中氧元素的化合价是-2价,氢元素和氯元素均是+1价,所以结构式是H-O-Cl,C正确;D、CH3CHOHCH(CH3)2名称是3-甲基-2-丁醇,D不正确,答案选C。
本题难度:一般
5、填空题 过氧化银(Ag2O2)是银锌碱性电池正极的活性物质,可通过下列反应制备:
K2S2O8+2AgNO3+4KOH Ag2O2↓+2KNO3+2K2SO4+2H2O Ag2O2↓+2KNO3+2K2SO4+2H2O
(1)已知K2S2O8和H2O2含有一个相同的化学键,则该反应________?(填“是”或“不是”)氧化还原反应;已知下列反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+(未配平),反应中氧化剂与还原剂的物质的量之比为________。
(2)制备Ag2O2的反应进行完全后,经过滤、洗涤、干燥,即可得到Ag2O2,检验Ag2O2是否洗涤干净的方法是________。
(3)一种银锌(Ag2O2、Zn)碱性电池的电解质溶液为KOH溶液,电池放电时正极生成Ag,负极只生成一种化合物(只含有Zn、K、H、O),其中Zn元素的质量分数为30%,钾、锌两种元素的质量比为78?65,则该电池的总反应方程式为________。
(4)用银锌电池电解尿素[CO(NH2)2]的碱性溶液可制取H2,其装置如图所示(电解池中隔膜仅阻止气体通过,M、N均为惰性电极)。
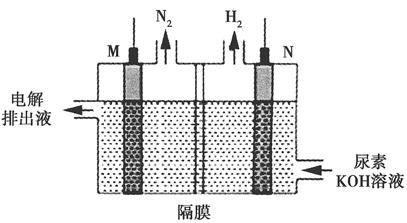
①N极与银锌电池的________(填“Zn”或“Ag2O2”)相连。
②M极的电极反应式为________________________。
参考答案:(1)不是 5?2
(2)取少量最后一次洗涤液,滴加1
本题解析:(1)根据题意可知,K2S2O8中含有过氧键,而生成物过氧化银中也有过氧键,该反应中各元素化合价没有发生变化,属于非氧化还原反应。Mn2+与S2O82-的反应中,氧化剂是S2O82-,还原剂是Mn2+,根据其化合价变化值可知其物质的量之比为5?2。
(2)根据中学所学知识,检验SO42-即可,但不能使用BaCl2或Ba(OH)2,因为原反应物中含有Ag+。
(3)首先根据题意确定负极产物的化学式,设负极产物的化学式为K2ZnOxHy,则:65/30.8%=211,211-65-78=68,分析
本题难度:一般
|