微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 0.5mol?Na2SO4中
A.含0.5个Na2SO4分子
B.含3.01×1023个SO42-
C.含0.5molNa+
D.含1mol氧原子
参考答案:B
本题解析:硫酸钠是离子化合物,不存在分子,A不正确;根据化学式可知,含有0.5molSO42-和1molNa+,而氧原子是2mol,所以答案选B。
本题难度:一般
2、选择题 除去二氧化碳中少量氯化氢气体的方法是使此气体通过(?? )
A.锌粒
B.石灰水
C.灼热的氧化铜
D.碳酸氢钠的饱和溶液
参考答案:D
本题解析:碳酸氢钠能和盐酸反应产生CO2,所 以选项D是最好的方案,A中锌和不氯化氢,同样氧化铜和氯化氢气体不反应,所以答案选D。
本题难度:一般
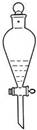
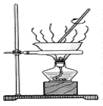
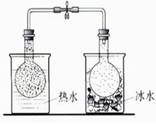
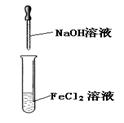
3、选择题 下列实验能达到目的的是
| 
| 
| 
|
用酒精萃取溴水中的溴
| 将硫酸铜溶液直接蒸干得到胆矾
| 说明2NO2(g)  N2O4(g)???△H<0 N2O4(g)???△H<0
| 实验室制备Fe(OH)2
|
A
| B
| C
| D
?
参考答案:C
本题解析:
试题分析:A、酒精与水互溶,不能萃取溴水中的溴,错误;B、胆矾是硫酸铜的结晶水合物,将硫酸铜溶液蒸干得不到胆矾,错误;C、热水中的烧瓶的颜色深,说明温度升高平衡逆向移动,所以正向是放热反应,正确;D、氢氧化亚铁不稳定,极易被氧气氧化,所以如图上操作得不到氢氧化亚铁,错误,答案选C。
本题难度:一般
4、填空题 镁是“国防金属”,从海水中提取镁通常要经历三大步骤见下图:

请回答下列问题:
(1)步骤1是提高海水中Mg2+浓度,方法是????????????????。
(2)步骤2的离子方程式为?????????????????????。
已知Mg(OH)2的Ksp=5.61×10-12,假设浓缩海水中MgCI2浓度为3mo1/L,则要使Mg2+形成Mg( OH )2沉淀,则加入沉淀剂后海水中的OH-浓度至少要达到?????????????????。
工业生产为了获得更高的利润,根据表1分析,最合理的沉淀剂是_??????????,生产这种沉淀剂的方法是????????????????????????????????????????????????????????????。
表1试剂价格
试剂
| KOH
| NaOH
| Ca(OH)2
| 价格(元/吨)
| 6800
| 3200
| 1200
?
(3)步骤3如何实现?两位同学设计下列方案:

这两种方案是否合理?请你评价:
方案一:??????????????????????????????????????????????????????????????????。
方案二:??????????????????????????????????????????????????????????????????。
你的设计方案是什么?写出流程图:
???????????????????????????????????????????????????????????????????????????。
参考答案:(15分)(1)取海水晒盐后的苦卤水作原料(其它合理答案给分
本题解析:
试题分析:(1)海水Mg2+中浓度很小,因此提高海水中Mg2+浓度的方法是取海水晒盐后的苦卤水作原料。
(2)步骤2的目的是将Mg2+转化为氢氧化镁沉淀,所以有关反应的离子方程式为Mg2++2OH-=Mg(OH)2↓或Mg2++Ca(OH)2=Mg(OH)2↓+Ca2+;根据氢氧化镁的溶度积常数可知,浓缩海水中MgCI2浓度为3mo1/L,要使Mg2+形成Mg( OH )2沉淀,则加入沉淀剂后海水中的OH-浓度至少要达到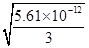 = = ×10-6mol/L;从经济效益和来源来看,最合理的沉淀剂应该是氢氧化钙。产生氢氧化钙的方法是以海边的贝壳高温分解制生石灰,生石灰与水反应制得石灰乳。 ×10-6mol/L;从经济效益和来源来看,最合理的沉淀剂应该是氢氧化钙。产生氢氧化钙的方法是以海边的贝壳高温分解制生石灰,生石灰与水反应制得石灰乳。
(3)由于H2、C或CO均不能还原MgO所以方案一不合理;又因为MgO熔点高,能耗大,不经济,因此方案二也不合理;正确的方案应该是将氢氧化镁转化为氯化镁,然后电解熔融的氯化镁即可。流程图如下: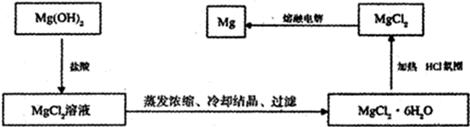 。 。
本题难度:一般
5、选择题 下列实验中,能获得成功的是( )
A.用高锰酸钾溶液来除去混在乙烷中的乙烯
B.苯、浓硝酸共热制硝基苯
C.用溴水除去混在苯中的己烯
D.苯、液溴、溴化铁混合制溴苯
参考答案:A.乙烯被高锰酸钾氧化为二氧化碳,引入了新的杂质,故A错误;
本题解析:
本题难度:简单
|
|