微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 明矾的化学式为KAl(SO4)2·12H2O,向明矾溶液中滴加Ba(OH)2溶液,当SO42-沉淀完全时,铝元素的存在形式是?
[???? ]
A.部分为Al(OH)3沉淀,部分以Al3+形式存在
B.全部为Al(OH)3沉淀
C.部分为Al(OH)3,部分为[Al(OH)4]-
D.全部以[Al(OH)4]-形式存在
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列说法中正确的是( )
A.溶液是电中性的,胶体是带电的
B.SiO2是将太阳能转化为电能的常用材料
C.原电池中盐桥的作用之一是使电解质溶液中的阴阳离子通过盐桥进行传递
D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
参考答案:A、胶体是电中性的,胶体胶粒带电荷,故A错误;
B、将
本题解析:
本题难度:简单
3、计算题 由铝和某种金属A组成的混合物,将它分成二等份,一份放入过量的盐酸中,混合物完全溶解,放出H2共12.32L(标准状况),溶液质量增加了9.7g,另一份放入过量烧碱溶液中,充分反应后放出H2共8.96L(标准状况),溶液质量增加了6.4g,而某金属A不反应,试推断未知金属A。
参考答案:A∶Mg
本题解析:定量确定元素种类,通常采用计算原子量与化合价的比值,然后再讨论确定的方法。设A金属的原子量为M,化合价为n,则:
2Al+6HCl=2AlCl3+3H2↑???????????????????????????①
2Al+2NaOH+2H2O=2NaAlO2+3H2↑???????????????????②
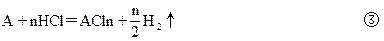 本题难度:一般
本题难度:一般
4、选择题 下列实验过程中产生的现象与对应的图形不相符合的是
A.在AlCl3溶液中滴加氨水至过
B.向NaOH溶液中滴加AlCl3溶液至过量且边滴边振荡
C.向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
D.向偏铝酸钠溶液中逐渐通入二氧化碳至过量
参考答案:A
本题解析:分析:A、氯化铝溶液中滴加氨水至过量,应生成沉淀氢氧化铝,由于氢氧化铝不溶于弱碱,所以氯化铝沉淀完全后不再变化;
B、向NaOH溶液中滴加AlCl3溶液至过量且边滴边振荡,先生成偏铝酸钠,开始无沉淀生成,氢氧化钠反应完全后继续滴入氯化铝会和偏铝酸钠反应生成沉淀;
C、向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡,开始会生成沉淀,当偏铝酸钠完全沉淀后继续滴入盐酸,沉淀会溶解;
D、向偏铝酸钠溶液中逐渐通入二氧化碳至过量,由于碳酸的酸性强于氢氧化铝,所以通入二氧化碳会不断生成沉淀到偏铝酸钠完全沉淀后,沉淀量不再变化.
解答:A、氯化铝溶液中滴加氨水至过量,应生成沉淀氢氧化铝,由于氢氧化铝不溶于弱碱,所以氯化铝沉淀完全后不再变化,发生的反应为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故A错误;
B、向NaOH溶液中滴加AlCl3溶液至过量且边滴边振荡,先生成偏铝酸钠,开始无沉淀生成,氢氧化钠反应完全后继续滴入氯化铝会和偏铝酸钠反应生成沉淀,发生的反应是:
Al3++4OH-=AlO2-+2H2O,3AlO2-+6H2O+Al3+=4Al(OH)3↓,两过程中氯化铝的用量为3:1,与图象符合,故B正确;
C、向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡,开始会生成沉淀,当偏铝酸钠完全沉淀后继续滴入盐酸,沉淀会溶解,发生的反应为:AlO2-+H++H2O=Al(OH)3↓;Al(OH)3+3H+=Al3++3H2O,两过程消耗盐酸量为1:3,与图象符合,故C正确;
D、向偏铝酸钠溶液中逐渐通入二氧化碳至过量,由于碳酸的酸性强于氢氧化铝,所以通入二氧化碳会不断生成沉淀到偏铝酸钠完全沉淀后,沉淀量不再变化,发生的反应为:
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,与析图象符合,故D正确;
故选A.
点评:本题考查了铝盐、偏铝酸盐与强酸强碱、弱酸弱碱反应数沉淀的变化,以图象题形式考查物质之间的反应,题目难度中等,根据反应过程判断,注意顺序不同,量不同导致产物不同.
本题难度:一般
5、选择题 除去镁粉中混有的少量铝粉, 可选用的试剂是( )
A.盐酸
B.NaOH溶液
C.硝酸
D.食盐水
参考答案:B
本题解析:要除去镁粉中混有的少量铝粉,除杂过程中要遵循:不增加新的杂质,原物质不得减少,易分离杂质,原物质易复原。显然除杂试剂不能和镁条反应,同时要除去铝粉,选NaOH溶液,充分反应后过滤操作就可以得到纯净的镁粉了。所涉及的方程式:2Al+2NaOH+2H2O=2NaAlO2+ 3H2↑。
本题难度:简单