微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 将23g金属钠投入180g水中,待充分反应后,求:
(1)??生成的氢气在标准状况下的体积?
(2)??反应后的溶液中钠离子与水分子的个数比?
参考答案:每一问各3分?? 11.2L?,1:9
本题解析:
试题分析:23g钠的物质的量是23g÷23g/mol=1.0mol
180水的物质的量是180g÷18g/mol=10mol
2Na+2H2O=2NaOH+H2↑
2mol 2mol 2mol? 22.4L
1mol 1mol 1mol? 11.2L
即生成的氢气是11.2L
反应后的溶液中钠离子与水分子的个数比1;(10-1)=1:9
点评:该题是基础性试题的考查,难度不大,侧重对学生基础性知识的巩固和训练,有利于培养学生的规范答题能力,提高学生灵活运用
本题难度:一般
2、实验题 有人设计一个Na2O2与CO2反应实验装置图如下:
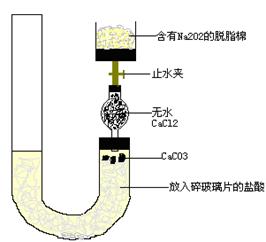
打开止水夹,发现CO2通过裹有Na2O2的脱脂棉,可观察到脱脂棉剧烈燃烧起来.
(1)由实验现象所得出的有关Na2O2与CO2反应的结论是:
a:有氧气生成:b:?????????????????????????????????
(2)甲、乙两位同学各称取质量为m g的过氧化钠与二氧化碳反应后的样品,并用下图所示仪器测定样品的组分。

请回答下列问题:
①甲同学通过实验测得的数据是氧气的体积,该同学读取实验数据时应注意冷却至室温、____________、眼睛视线与凹液面最低处相切。
②乙同学通过连接仪器①②进行实验,他测得的数据是?????????????。按他测得的数据计算出的实验结果偏高,理由是?????????????????????。
③为了测得准确的实验数据,请你将乙同学的实验装置进行改进(每种仪器只准使用一次),写出各仪器接口的连接顺序???????????????????????????。
④按③设计的实验装置进行实验,若测得实验前后装置②的质量分别是w1 g和w2 g,则样品中碳酸钠的质量分数为???????????????????????。
⑤在③的改进装置中由于受到仪器的局限,是否也有不足之处??????(若没有,此空不必回答;若有,请一并说出不足的理由)?????????????????。
参考答案:(1)b:该反应是放热反应。(2)①调节④⑥液面高度相同②二
本题解析:本题主要是探究Na2O2和CO2反应的实质。⑴Na2O2遇CO2能使脱脂棉剧烈燃烧起来,从燃烧的条件可知,必须有氧气生成,而且该反应还要放出大量的热。(2)本题涉及定量测气体体积与气体质量的区别。若通过实验测得氧气的体积,则应采用排液量气装置,因为反应生成的是氧气和二氧化碳的混合气体,先除杂,再量气。若通过实验测得二氧化碳的质量,则必须保证反应产生的二氧化碳全部被碱石灰吸收,但如果只连接①②,则反应产生的水蒸气以及空气中的水蒸气、二氧化碳也可能被碱石灰吸收,使结果偏大,如果改进应该在②前后分别加上干燥装置
本题难度:简单
3、选择题 2003年诺贝尔化学奖授予了美国科学家Peter Agre和Roderick Mackinnon以表彰他们在“水通道”和“离子通道”的研究成就。Mackinnon教授的研究内容主要是Na+、K+体积很接近,但在生物体内呈现的差别却高达1万倍,他革命性的让科学家观测Na+、K+在进入离子通道前、通道中以及穿过通道后的状态,可为病人在“离子通道”中寻找具体的病因,并研制相应药物。下列关于钠、钾的说法正确的是
A.单质钠的密度比钾的密度小
B.Na+和K+常用作氧化剂
C.钠和钾都是短周期元素
D.钠和钾的合金[ω(K)=50%~80%]在室温下呈液态
参考答案:D
本题解析:
试题分析:A、单质钠的密度比钾的密度大,这是特殊性,错误;B、Na和K均为活泼金属,Na+和K+具有很弱的氧化性,一般不用作氧化剂,错误;C、钾位于第四周期,属于长周期元素 ,错误;D、钠和钾的合金[ω(K)=50%~80%]在室温下呈液态,可做原子反应堆的导热剂,正确。
本题难度:一般
4、选择题 2003年诺贝尔化学奖授予美国科学家Peter Agre和Roderick Mackinnon以表彰他们在“水通道”和“离子通道”的研究成果。Mackinnon教授的研究内容主要是Na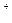 、K
、K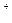 虽然体积很接近,但在生物体内呈现的差别却高达1万倍,他让科学家们观测到Na
虽然体积很接近,但在生物体内呈现的差别却高达1万倍,他让科学家们观测到Na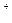 、K
、K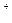 在进入离子通道前、通道中以及穿过通道后的状态,在医学应用上可为病人在“离子通道”中寻找具体的病因,并研制相应药物。下列关于钠、钾的说法正确的是(?)
在进入离子通道前、通道中以及穿过通道后的状态,在医学应用上可为病人在“离子通道”中寻找具体的病因,并研制相应药物。下列关于钠、钾的说法正确的是(?)
A.质钠的密度比钾的密度小
B.和钾在空气中燃烧的产物都是过氧化物
C.一小块钠投入盛5 mL澄清石灰水的试管里,可能观察到溶液变浑浊
D.和钾的合金〔w(K)=50%~80%〕熔点比钠和钾都高
参考答案:C
本题解析:本题以诺贝尔化学奖获得者的研究成果为背景命题,考查了金属钠、钾的性质和用途(新考纲增加知识点)及溶解度变化等知识点。详细的解答过程为:碱金属的密度总体上随原子序数增大而增大,但钠的密度反常(比钾大);钠在空气中燃烧的产物是过氧化钠,但钾在空气中燃烧的产物中还有超氧化钾;将钠投入澄清石灰水中会和水发生反应且放出热量,若石灰水是饱和的(氢氧化钙的溶解度随温度升高而减小),则会有少量Ca(OH)2析出来。
本题难度:简单
5、选择题 当水和铷与另一种碱金属的合金7.8 g完全反应时,放出的氢气在标准状况下为0.2 g,则合金中另一金属可能是(???)
A.钠
B.钾
C.铷
D.铯
参考答案:A
本题解析:本题可用“平均值法”解题。
设金属平均相对原子质量为x。
M — 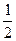 H2
H2
x?????? 1
7.8 g?? 0.2 g
解得:x=39
因铷的相对原子质量>39
所以另一种碱金属的相对原子质量应比39小,故可能为Li或Na。
本题难度:简单