微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 把河沙(主要成分是SiO2)与镁按一定质量比(质量之比约为15∶24)混合均匀,装入试管中加热大约1 min后发生剧烈反应,生成一种白色固体化合物和一种硅化物,待生成的混合物冷却后放入盛有稀H2SO4的烧杯中,立即产生气泡并伴有爆炸声,产生的气体是一种能在空气中自燃的气态氢化物。
(1)写出河沙与镁粉在加热条件下的化学反应方程式:_________________________,该反应是_____________(填“放热”或“吸热”)。
(2)生成的混合物放入稀H2SO4中,产生的气体是_____________。
(3)写出产生“爆炸声”的化学反应方程式:_________________________________。
参考答案:(1)4Mg+SiO2 本题解析:根据题意,参加反应的SiO2与Mg的物质的量之比为
本题解析:根据题意,参加反应的SiO2与Mg的物质的量之比为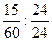 =1∶4,由质量守恒定律可写出该反应的化学反应方程式:4Mg+SiO2
=1∶4,由质量守恒定律可写出该反应的化学反应方程式:4Mg+SiO2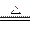 Mg2Si+2MgO,加热1 min后发生剧烈反应,说明反应放热。Mg2Si与稀H2SO4的反应可类比FeS与稀H2SO4的反应:Mg2Si+2H2SO4====2MgSO4+SiH4↑,SiH4可与CH4类比。由于反应放出大量气体,会产生“爆炸声”,SiH4的稳定性比CH4差,化学性质更活泼,因此SiH4能在空气中自燃。
Mg2Si+2MgO,加热1 min后发生剧烈反应,说明反应放热。Mg2Si与稀H2SO4的反应可类比FeS与稀H2SO4的反应:Mg2Si+2H2SO4====2MgSO4+SiH4↑,SiH4可与CH4类比。由于反应放出大量气体,会产生“爆炸声”,SiH4的稳定性比CH4差,化学性质更活泼,因此SiH4能在空气中自燃。
本题难度:简单
2、选择题 在化学实验中,下列仪器不能加热的是(??? )
A.容量瓶
B.蒸馏烧瓶
C.锥形瓶
D.蒸发皿
参考答案:A
本题解析:考查仪器的使用
四仪器中容量瓶是专门用来配制溶液的仪器,不能用来加热,其它均可,选A
本题难度:简单
3、选择题 下列实验操作或记录正确的是
A.用两只250 mL的容量瓶配制0.1 mol/L 500 mL的NaOH溶液
B.用量筒测得排水法收集制得的氢气体积为50.28 mL
C.常温常压下测得1 mol N2的质量为28 g
D.用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g
参考答案:C
本题解析:
试题分析:A、用两只250 mL的容量瓶配制0.1 mol/L 500 mL的NaOH溶液,容易造成试验误差,应该用500ml容量瓶配制0.1 mol/L 500 mL的NaOH溶液,A不正确;B、量筒只能读数到0.1ml,所以用量筒测得排水法收集制得的氢气体积不可能为50.28 mL,B不正确;C、氮气的摩尔质量是28g/mol,素以常温常压下测得1 mol N2的质量为28 g,C不正确;D、托盘天平只能读数到0.1g,因此不可能用托盘天平称得2.50 g胆矾,D不正确,答案选C。
本题难度:一般
4、选择题 下列操作方法或实验装置正确的是[???? ]
A.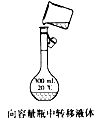
B.
C.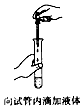
D.
参考答案:D
本题解析:
本题难度:一般
5、实验题 亚硝酸盐是一祌常见的食品添加剂,使用时必须严格控制其用量。为检测某食品中亚硝酸盐含量(通常以1kg样品中含NaNO2的质量计),某研究小组设计了如下两种实验方案: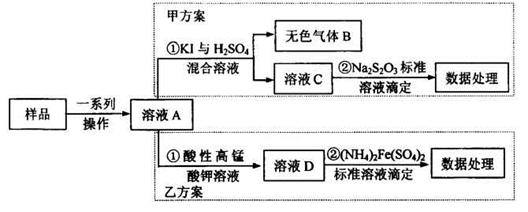
(1)无色气体B遇空气显红棕色,B的化学式为_______写出甲方案①中反应的离子方程式_______
(2)完成并配平乙方案①中反应的离子方程式
MnO4-+??NO2-+?????????=???Mn2++???NO3-+?????????,
(3)乙方案②中需配置100mL0.0010mol/L(NH4)2Fe(SO4)2标准溶液,在已准确称量样品的质量后,还需要的仪器有:量筒、烧杯、_______配制溶液时,定容的操作方法是______
(4)若取样品ag,按乙方案进行测定,准确量取12.00mL0.0005mol/L的酸性高锰酸钾溶液(过童)与溶液A反应。反应后溶液用0.0010mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色溶液刚好褪去;重复上述实验2次,平均消耗(NH4)2Fe(SO4)2溶液10.00mL.则1kg样品中NaNO2的质量为_______mg.
参考答案:(14分)
(1)NO?(1分),? 2I- +2NO
本题解析:
试题分析:工艺流程的解题的关键,搞清楚加入了什么物质,发生什么反应(氧化还原反应居多),如何分离等。方案甲和乙分别为氧化还原反应,甲方案用到亚硝酸根的氧化性,方案乙用到亚硝酸根的还原性,两方程式分别为,甲:2I- +2NO2-+4H+ =I2+ 2NO↑+2H2O;乙:2MnO4-+ 5NO2-+ 6 H+? =" 2" Mn2+? + 5NO3-+ 3H2O;然后甲用Na2S2O3滴定I2,乙用(NH4)2Fe(SO4)2滴定过量高锰酸钾;根据滴定的量可以计算。(4)5Fe2+~MnO4-;n(MnO4-)=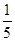 ×0.0010×0.01=2×10-6mol,乙方案中消耗的高锰酸钾为0.012L×0.0005mol/L-2×10-6mol=4×10-6mol;n(NaNO2)=
×0.0010×0.01=2×10-6mol,乙方案中消耗的高锰酸钾为0.012L×0.0005mol/L-2×10-6mol=4×10-6mol;n(NaNO2)=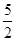 ×4×10-6mol=10-5mol,故每kg中含有690/amg。
×4×10-6mol=10-5mol,故每kg中含有690/amg。
本题难度:一般