微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
步骤一:配制250mL?0.10mol/L?NaOH标准溶液.
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作4次,记录数据如下.
| 实验编号 | NaOH溶液的浓度
(mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL)
1
0.10
20.02
20.00
2
0.10
20.00
20.00
3
0.10
19.00
20.00
4
0.10
19.98
20.00
(1)步骤一需要称量氢氧化钠固体的质量为______g,配制标准溶液需要用到玻璃棒,烧杯外,还需要的玻璃仪器有______.
(2)步骤二中量取20.00mL的稀盐酸用到的仪器是______.滴定达到终点的现象是______.
(3)根据上述数据,可计算出该盐酸的浓度为______.
(4)排去滴定管中气泡的方法应采用如图的______操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
(5)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有______(多选扣分):
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数;
E.碱式滴定管尖嘴部分有气泡,滴定后消失.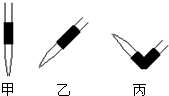
2、简答题 (1)用已知物质的量浓度的酸来测定未知物质的量浓度的碱,滴定时:用左手______,右手______,眼睛应紧盯______,当最后一滴刚好使指示剂颜色发生明显的改变而且______内不恢复原来的颜色,即为滴定终点.
(2)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验.某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液.下列有关说法中正确的是______.
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E.用甲基橙作指示剂,滴定终点时,溶液颜色从橙色变为红色;
F.配制溶液和中和滴定的两个实验中,若在最后一次读数均俯视读数,则导致实验结果都偏大.
3、选择题 用标准的KOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是( )
A.配制标准溶液的固体KOH中混有NaOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
4、简答题 今欲用NaOH固体配制250mL?0.2mol/L的NaOH溶液.
(1)某同学配制过程中移液操作如图,其中可见两处错误:①______?②______
(2)用______(填滤纸或小烧杯)在托盘天平上称取______?NaOH固体.
(3)配制好的溶液______(填“能”或“不能”)长期存放在容量瓶中.
(4)以下因素会造成实验结果偏低的是______
A.容量瓶中原来有少量蒸馏水????B.定容时观察液面俯视
C.忘记洗涤????????????????????D.定容时观察液面仰视.
5、简答题 某校学生用中和滴定法测定某NaOH溶液的物质的量浓度.
(1)盛装0.2000mol/L盐酸标准液应该用______式滴定管.
(2)当接近滴定终点时,很少量的碱或酸就会引起溶液的______发生突变.
(3)有关数据记录如下:
| 实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL)
滴定前
滴定后
1
20.00
0.50
20.70
2
20.00
6.00
26.00
3
20.00
1.40
21.20
则NaOH溶液的物质的量浓度为______mol/L.
(4)若只用蒸馏水冲洗锥形瓶,则测定结果______(填“无影响”、“偏高”或“偏低”).
|
|