微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某元素的一种同位素X原子的质量数为A,含N个中子,它与1H原子组成HmX分子,在ag HmX分子中含质子的物质的量是(??? )
A.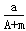 (A+N+m)mol
(A+N+m)mol
B.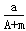 (A-N+m)mol
(A-N+m)mol
C.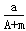 ( A-N)mol
( A-N)mol
D.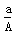 (A-N)mol
(A-N)mol
2、选择题 以下有关原子结构及元素周期律的叙述中正确的是(??)
A.第IA族碱金属元素最高价氧化物的水化物的碱性随原子序数递增而增强
B.同周期元素(除0族元素外)从左到右,原子半径和离子半径都逐渐减小
C.第ⅦA元素从上到下,其氢化物的稳定性逐渐增强
D.同主族元素从上到下,电负性逐渐增大
3、判断题 A、B、C、D、E五种元素,它们的原子序数由A至E逐渐增大。D 的氢化物的分子式为H2D;D的最高价氧化物中D的质量分数为40%,且D原子的原子核中质子数和中子数相等。A原子最外电子层有4个电子。B的阴离子与C的阳离子和氖原子的电子层结构相同。E原子的M电子层上共有7个电子。常温常压下,B单质是气体,已知0.1 mol的B 单质与H2完全反应需2.408×1023个氢原子。C单质在加热条件下与B单质反应生成淡黄色固体。根据上述情况,试完成下列各问题:
(1)A—E的元素符号为___________、___________、___________、___________、___________。
(2)C位于元素周期表中第___________周期、第___________族,其阳离子的结构示意图为___________。
(3)D原子的电子式为___________;E离子的符号为___________。
(4)A元素与其余4种元素形成化合物的化学式为(仅限于由2种元素组成) ___________、___________、___________、___________。
(5)C单质和B单质在加热条件下生成A2B2反应的化学方程式为______________________;
反应中___________为氧化剂,___________为还原剂。
(6)1.15 g的C单质溶于50 mL水中,所得溶液中溶质的质量分数为___________。
4、填空题 已知元素的电负性和原子半径一样,也是元素的一种基本性质,下面给出14种元素的电负性:
?元素
| ? Al?????
| ?? B?
| ? Be
| ?? C
| ?? Cl
| ?? F
| ?? Li
|
电负性
| ?1.61?
| ? 2.04
| ? 1.57
| ? 2.55
| ? 3.16
| ? 3.98
| ? 0.98
|
?元素
| ? Mg
| ?? N
| ? Na
| ?? O
| ? P
| ? S
| ? Si
|
电负性
| ?1.31
| ? 3.04
| ? 0.93
| ? 3.44
| ? 2.19
| ? 2.58
| ? 1.90
(1)根据上表给出数据,可推知元素的电负性具有的变化规律是____________________
(2)预测Br与I元素电负性的大小关系是__________________,电负性最小的元素在周期表中的位置是________________________。(放射性元素除外)
(3)离子化合物和共价化合物之间没有绝对的界限,习惯上把SrI2看作离子化合物,把BaS看作共价化合物。(电负性:Sr=0.95;I=2.66;Ba=0.89;S=2.58)我们把两成键原子的电负性差值用△X表示,请找出用△X来判断离子键或共价键的数值范围:
即当△X___________时一般为共价键,当△X___________时一般为离子键。试判断AlBr3中化学键的类型是__________。
5、选择题 X元素最高氧化物对应的水化物为H3XO4,则它对应的气态氢化物为(??)
A.HX
B.H2X
C.XH4
D.XH3
|