微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)A、B、C是中学化学中常见的三种短周期元素。已知:①A元素原子最外层电子数是次外层电子数的2倍;②B元素最高正价与最低负价的代数和为2;③C元素有多种化合价,且常温下C元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物;④B、C两种元素质子数之和是A元素质子数的4倍。
(1) 写出A元素在周期表中的位置_______________________。
(2) 写出C的单质和强碱溶液反应的离子方程式____________________________________。
(3) 意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的B4气态分子。B4分子结构与白磷分子结构相似 ,已知断裂1 mol B—B吸收167 kJ的热量,生成1 mol B≡B放出942 kJ热量。试写出由B4气态分子变成B2气态分子的热化学方程式:____________________________。
,已知断裂1 mol B—B吸收167 kJ的热量,生成1 mol B≡B放出942 kJ热量。试写出由B4气态分子变成B2气态分子的热化学方程式:____________________________。
(4) 由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形
分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X的结构式为____________,X与水反应的化学方程式是___________________。
(5) A、B两种元素可形成一种硬度比金刚石还大的化合物Y。在化合物Y中,A、B原子间以单键相结合,且每个原子的最外层均达到8个电子的稳定结构。则Y的化学式为______________,Y晶体的熔点比金刚石熔点______(填“高”或“低”)。
(6) B2H4是一种可燃性液体,其水溶液呈弱碱性,是因为溶液中存在平衡:
H2B-BH2+H2O _________________________。
_________________________。
参考答案:每空2分,共16分
(1)?第二周期ⅣA族?? (2
本题解析:分析得A、B、C分别是C、N、Cl,A元素在周期表中的位置是第二周期ⅣA族;C的单质和强碱溶液反应的离子方程式C12+2OH-=ClO-+H2O+Cl-;根据题意N4(g)生成2N2(g),需要断裂6 mol 1 mol B—B吸收1002kJ的热量,生成,2 mol B≡B放出1884kJ热量,共放出882 kJ的热量,N4(g) ====2N2(g)???△H=-882 kJ/mol。
(4)中N、Cl形成三角锥形分子,而且都达到8个电子的稳定结构,则化学式为NCl3,结构式为
本题难度:一般
2、填空题 请回答以下问题:
(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元素对应原子的M层电子排布式为???.
(2)如下图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是???.简述你的判断依据???.
(3)CO2在高温高压下所形成的晶体其晶胞如下图3所示.该晶体的类型属于???(选填“分子”“原子”“离子”或“金属”)晶体,该晶体中碳原子轨道的杂化类型为???。
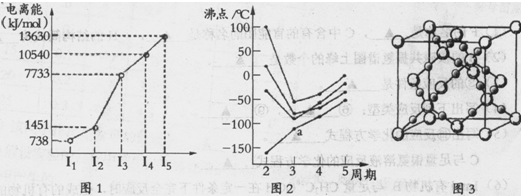
(4)在离子晶体中正、负离子间力求尽可能多的接触,以降低体系的能量,使晶体稳定存在。已知Na+半径是Cl-的a倍,Cs+半径是Cl-的b倍,请回顾课本上NaCl和CsCl的晶胞,其晶胞边长比为???.
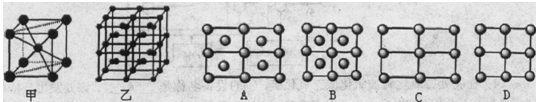
(5)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图中正确的是???.铁原子的配位数是???,假设铁原子的半径是r cm,该晶体的密度是p g/cm3,则铁的相对原子质量为?????(设阿伏加德罗常数的值为NA)。
参考答案:(1)3s23p6(2分)
(2)SiH4 (1分);
本题解析:
试题分析:(1)该元素第三电离能远远大于第二电离能,说明该元素的原子价电子数为2,为Ca,M层电子排布式为:3s23p6
(2)在ⅣA~ⅦA中的氢化物里,NH3、H2O、HF因分子间存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象,第ⅣA族形成的氢化物分之间为范德华力,组成与结构相似,相对分子量越大,范德华力越大,沸点越高,所以a点所在折线对应的是气态氢化物SiH4。
(3)由CO2在高温高压下所形成的晶体图可以看出,其晶体结构为空间物质结构,每个C原
本题难度:困难
3、填空题 A、B、C、D、E均为短周期元素,其化合价与原子序数的关系如下图所示。
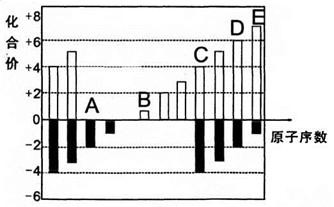
(1)A、B、C、D四种元素中第一电离能最小的是???(填元素名称),其基态原子核外电子排布式是???,
(2)D、E的最高价氧化物的水化物中,酸性较强的是???????(写化学式)。
D的氢化物沸点比A的氢化物沸点?????(填“高”或“低”)。
(3)化合物CA2的晶体类型是______,CA2与B最髙价氧化物的水化物溶液发生反应的离子方程式是_______
(4)在298K、101.3kPa下,1.6gD单质在足量的氧气中燃烧,放出14.85kJ热量,该反应的热化学方程式是______________
参考答案:(共16分)
(1)钠(2分)???? 1s22s22
本题解析:
试题分析:有化合价可以推知A、B、C、D、E分别为O、Na、Si、S、Cl。
(1)金属性越强,越易失电子,第一电离能越小,故Na最小;
(2)非金属性越强,最高价氧化物对应水化物的碱性越强,非金属Cl>S,H2O存在氢键,故沸点较高;
(3)SiO2为原子晶体,为酸性氧化物,可以与强碱发生反应;
(4)1.6gS,物质的量为0.05mol,故1molS反应放出的热量为14.85KJ/0.05mol=297.0KJ/mol;从而写出热化学方程式。
本题难度:一般
4、选择题 下列各种元素的原子序数,期中能组成化学式为XY2型离子化合物的是( )
A.6和8
B.16和8
C.12和17
D.11和16
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列分子中的中心原子的杂化类型为sp2杂化的是( )
A.BeCl2
B.NH3
C.BF3
D.H2O
参考答案:C
本题解析:A是直线型结构,中心原子是sp杂化,B和D都是sp3杂化,BF3是平面三角形结构,所以中心原子是sp2杂化,答案选C。
本题难度:简单