微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 ⑴(7分)高温下,某反应达到平衡,平衡常数K=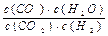 。
。
①该反应化学方程式为?????????????????????????????????????????????????。
②若恒容时,温度升高,H2浓度减小,则该反应焓变为?????????(填正值或负值)。
③恒温恒压下,若继续向原平衡混合物的容器中通入少量氦气(假设氦气和各物质不反应)后,化学平衡??????????????移动;反应物的转化率??????????(填增大、减小、或不变);H2的浓度
???????????(填增大、减小、或不变);
⑵(6分)可逆反应: X+ 3Y(g)? ??2Z(g) +2W(g)达到平衡,混
??2Z(g) +2W(g)达到平衡,混
合物中Y的体积分数随压强(P)与温度T(T2>T1)的变化关系如图示。

①当压强不变时,升高温度,Y的体积分数变?????????????,
平衡向??????方向移动,则正反应是????????????热反应。
②当温度不变时,增大压强,Y的体积分数变 ???????,
平衡向?????????方向移动,则X的状态是????????????????
2、选择题 可逆反应H2(g)+I2(g)  ?2HI(g)在密闭容器中反应,达到平衡状态时的标志是(????)???
?2HI(g)在密闭容器中反应,达到平衡状态时的标志是(????)???
A.混合气体的密度不再改变
B.混合气体的颜色不再改变
C.混合气体的压强不再改变
D.I2、H2在混合气体中的体积分数相等
3、选择题 对于达到平衡的反应:2A(g)+B(g) nC(g),符合右图所示的结论是(????)
nC(g),符合右图所示的结论是(????)

A.P1>P2,n>3
B.P1>P2,n<3
C.P1<P2,n>3
D.P1<P2,n<3
4、选择题 2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+Cl2(g)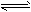 PCl5(g);反应达到平衡时,PCl5为0.4mol;如果此时移走1.0molPCl3和
PCl5(g);反应达到平衡时,PCl5为0.4mol;如果此时移走1.0molPCl3和
0.5molCl2,在相同的温度下再达到平衡时,PCl5的物质的量为[???? ]
A.0.4mol
B.0.2mol
C.小于0.2mol
D.大于0.2mol,小于0.4mol
5、填空题 (本题16分)降低大气中CO2的含量和有效地开发利用CO2正成为研究的主要课题。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)??ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g)??ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l)??ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:?????????????????????。
(2)在容积为2L的密闭容器中,充入2mol CO2和6mol H2,在温度500℃时发生反应:
CO2(g)+ 3H2(g)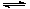 CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:
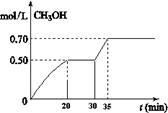
①从反应开始到20分钟时,H2的平均反应速率v(H2)=_________________。
②从30分钟到35分钟达到新的平衡,改变的条件可能是?????????????。
A. 增大压强??? B.加入催化剂?? C.升高温度??? D.增大反应物的浓度?
③列式计算该反应在35分钟达到新平衡时的平衡常数(保留2位小数)
④如果在30分钟时,再向容器中充入2mol CO2和6mol H2,保持温度不变,达到新平衡时,CH3OH的浓度____________1mol.L-1(填“>”、“<”或“=”)。
(3)一种原电池的工作原理为:2Na2S2 + NaBr3  Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
①该电池负极的电极反应式为:??????????????????????????????????????????????。
②电解池中产生CH4一极的电极反应式为:?????????????????????????????????????。
(4)下图是NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。
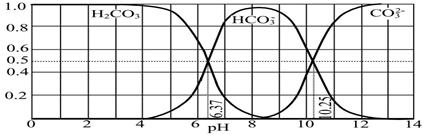
下列叙述正确的是?????????????。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间