微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
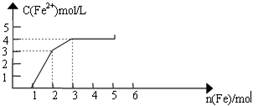
1、选择题 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
A.1:1:4
B.1:3:1
C.3:3:8
D.1:1:1
参考答案:A
本题解析:
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,由图可知,加入1molFe,亚铁离子的浓度的不变,
则发生Fe+4HNO3═Fe(NO3)3+NO↑+2H2O,
1?? 4????? 1
再加入1molFe发生Fe+2Fe3+═3Fe2+,
1?? 2??? 3
所以n(HNO3)=4mol,n(Fe3+)=2mol-1mol=1mol,
再加铁粉时亚铁离子的浓度增加,
发生Fe+Cu2+═Fe2++Cu,
1
本题难度:简单
2、选择题 一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通入乙烷和氧气,其电极反应式为:C2H6+18OH--14e - =2CO32-+12H2O
7H2O+7/2O2+14e -=14OH-,有关此电池的推断正确的是(???? )
A.通氧气的电极为负极
B.参加反应的氧气与C2H6的物质的量之比为7∶2
C.放电一段时间后,KOH的物质的量浓度不变
D.电解质溶液中CO32-向正极移动
参考答案:B
本题解析:
试题分析:A项在燃料电池中,通入氧气的一极为原电池的正极,发生还原反应,通乙烷的电极为负极,发生氧化反应,故A错误;B项原电池中两极上转移的电子相等,当有28mol电子转移时,正极上消耗7molO2,负极上消耗2molC2H6,物质的量之比为7:2,故B正确;C项电池工作过程中,电池总反应为2C2H6+8OH-+7O2=4CO32-+10H2O,反应消耗OH-离子,溶液的pH值逐渐减小,故C错误;D项CO32-向负极移动,故D错误。
点评:本题考查原电池知识,题目难度中等,注意电极反应式的书
本题难度:一般
3、选择题 下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
A.2.4 g金属镁变为镁离子时失去的电子数为0.1 NA
B.1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质的粒子数相等
C.在标准状况下,22.4 L CH4与18 g H2O所含有的电子数均为10 NA
D.CO和N2为等电子体,22.4 L CO气体与1 mol N2所含的电子数相等
参考答案:C
本题解析:A错,2.4 g金属镁变为镁离子时失去的电子数为0.2 NA;B错,0.5 mol/L盐酸没有溶液的体积,无法计算;C正确;D错,未指明在标准状况下;
本题难度:一般
4、选择题 质量相等的SO2与SO3,前者与后者所含氧原子个数之比是( )
A.1∶1
B.2∶3
C.6∶5
D.5∶6
参考答案:D
本题解析:为方便计算,设m(SO2)=m(SO3)="1" g,则
n(SO2中O原子)=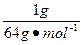 ×2=
×2=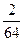 mol。
mol。
n(SO3中O原子)= 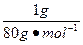 ×3=
×3=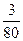 mol。
mol。
由于O原子个数之比等于O原子物质的量之比,所以答案为:
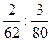 =5∶6。
=5∶6。
解法二:依据n=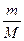 可知,质量相等时,两种物质的物质的量与其摩尔质量成反比,故可先求SO2和SO3的物质的量比,再求氧原子的个数比,因此有
可知,质量相等时,两种物质的物质的量与其摩尔质量成反比,故可先求SO2和SO3的物质的量比,再求氧原子的个数比,因此有
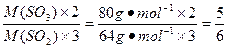 。
。
本题难度:一般
5、填空题 9.5gMgCl2固体溶于水配成500mL溶液,其浓度为???????mol·L-1,从中取出100mL溶液,其中Cl-的浓度为???????mol·L-1;再把取出的溶液加水稀释成500mL,则此时MgCl2溶液的浓度为???????mol·L-1。
参考答案:0.2 0.4 0.04
本题解析:略
本题难度:一般