微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 右图装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图.装置(Ⅰ)的离子交换膜只允许Na+?通过.已知电池充、放电的化学反应方程式为2Na2S2+NaBr3
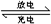
Na2S4+3NaBr.当闭合开关K时,X极附近溶液变红色.下列说法正确的是( )
A.闭合K时,钠离子从右到左通过离子交换膜
B.闭合K时,负极反应为3NaBr-2e-=NaBr3+2Na+
C.闭合K时,X电极的电极反应式为2Cl--2e-=Cl2↑
D.闭合K时,有0.1molNa+通过离子交换膜,X电极上析出标准状况下气体1.12L
参考答案:D
本题解析:
本题难度:一般
2、选择题 根据Zn+2H+ Zn2++H2↑的反应原理设计一个原电池,当Zn为负极时,正极可以选用的金属材料是(??? )
Zn2++H2↑的反应原理设计一个原电池,当Zn为负极时,正极可以选用的金属材料是(??? )
A.镁
B.石墨
C.铝
D.铅
参考答案:D
本题解析:根据原电池的总反应,负极为Zn,正极若为金属,则其金属活动性应比锌弱,所给选项中只有铅符合。故答案为D项。
本题难度:简单
3、选择题 用惰性电极电解400 mL一定浓度的硫酸铜溶液(不考虑电解过程中溶液体积的变化),通电一段时间后,如果向所得的溶液中加入0.05 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和体积(不考虑CO2的溶解),电解过程中转移的电子物质的量为(??)
A.0.2 mol
B.0.3mol
C.0.4 mol
D.0.6 mol
参考答案:B
本题解析:
试题分析:电解硫酸铜溶液后溶液呈酸性,向电解后的溶液中加入碱式碳酸铜能恢复成原溶液,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳(不考虑CO2的溶解),溶液质量增加的量是铜、氢氧根离子,所以实际上电解硫酸铜溶液分两个阶段:第一阶段2CuSO4+2H2O  2Cu↓+O2↑+2H2SO4,第二阶段:2H2O
2Cu↓+O2↑+2H2SO4,第二阶段:2H2O
本题难度:一般
4、选择题 根据下列事实,判断离子的氧化性顺序为①A + B2+ = A2+ + B? ②D + 2H2O = D(OH)2+H2↑?
③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2+ + 2e-= E,B - 2e- = B2+??(???)
A.E2+>B2+>A2+>D2+
B.D2+>A2+>B2+>E2+
C.D2+>E2+> B2+>A2+
D.A2+>B2+>D2+>E2+
参考答案:A
本题解析:考查金属性强弱比较。比较元素金属性强弱的依据
1.在一定条件下金属单质与水反应的难易程度和剧烈程度。一般情况下,与水反应越容易、越剧烈,其金属性越强。
2.常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强。
3.依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强
4.依据金属单质与盐溶液之间的置换反应。一般是活泼金属置换不活泼金属。但是ⅠA族和ⅡA族的金属在与盐溶液反应时,通常是先与水反应生成对应的强碱和氢气,然后强碱再可能与
本题难度:一般
5、填空题 (12分)某实验小组的同学对电化学原理进行了一系列探究活动
(1)如图为某实验小组依据氧化还原反应:(用离子方程式表示) 设计的原电池装置,反应前,两电极质量相等,一段时间后,两电极质量相差18g,则导线中通过 mol电子。
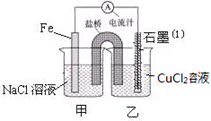
(2)用胶头滴管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式 ,然后滴加几滴硫氰化钾溶液,溶液变红;继续滴加过量新制饱和氯水,红色褪去,假设之一是“溶液中的+3价铁被氧化为更高的价态”。如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式 。
(3)如图其它条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,石墨(1)为 极(填“正”、“负”、“阴”或 “阳”)。在甲装置中滴加几滴酚酞试液,振荡均匀,一段时间后,在甲装置中观察到 电极(填“铁”或“铜”)附近溶液先变红,该电极的反应式为 。

参考答案:(12分)
(1)Fe+Cu2+==Fe2++Cu (
本题解析:
试题分析:(1)根据该原电池的电解质溶液及电极,判断该原电池的反应原理是Fe与铜离子的置换反应,离子方程式是Fe+Cu2+==Fe2++Cu;在该电池中Fe作负极,失去2个电子生成亚铁离子进入溶液,而石墨极为正极,铜离子得到2个电子生成Cu单质析出,开始两电极的质量相等,负极质量减少56g,则正极质量增加64g,两极的质量差为56g+64g=120g,所以当两电极质量相差18g时,有18/120mol=0.15molFe失去电子,则转移电子的物质的量是0.3mol;
(2)铁片附近的溶液中含有亚铁离子,滴加氯水,则氯气与亚铁离子反应生成铁离子和氯离子,离子方程式是2Fe2++Cl2==2Fe3++2Cl-;铁离子与KSCN溶液反应,溶液变红色;继续滴加过量新制饱和氯水,红色褪去,假设之一是“溶液中的+3价铁被氧化为更高的价态”。如果+3价铁被氧化为FeO42-,则氯气被还原为氯离子,根据元素守恒,则该反应中有O元素参与,所以反应中还有谁参加,生成物中有氢离子生成,离子方程式是2Fe3++3Cl2+8H2O==2FeO42-+6Cl-+16H+;
(3)若将盐桥换成弯铜导线与石墨相连成n型,则该装置为原电池和电解池的串联装置,甲池为原电池,乙池为电解池,Fe作负极,Cu为正极,则石墨极为电解池的阴极;甲为Fe的吸氧腐蚀反应,正极为氧气得到电子,与水结合生成氢氧根离子,Cu极附近溶液呈碱性,所以Cu极附近先变红色;该电极的反应式是O2+4e-+2H2O==4OH-。
考点:考查电化学反应原理的应用
本题难度:一般