微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 2.7g铝粉分别与体积均为100mL、浓度均为2mol/L的(1)硫酸溶液、(2)烧碱溶液、(3)盐酸完全反应,放出氢气的体积关系(相同条件)是
A.(1)=(2)=(3)
B.(1)=(2)>(3)
C.(1)>(2)>(3)
D.(2)>(1)=(3)
参考答案:B
本题解析:
试题分析:铝粉的量为0.1mol,溶液的量为0.2mol,本题要注意过量的计算,由计算可知,铝粉与硫酸、烧碱反应,铝粉均反应完全,故产生氢气一样多,为0.15mol,而铝粉与盐酸反应时,铝粉过量,因此产生氢气的量为0.1mol,因此(1)=(2)>(3)。
本题难度:一般
2、填空题 (8分)(1)从30mL0.5mol·L-1 NaOH溶液中取出10 mL:这10 mL溶液的物质的量浓度是??????????mol·L-1,其中的溶质质量是?????g。
(2)将30mL0.5mol·L-1 NaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度是????????mol·L-1。
(3)现有体积相同的NaCl、MgCl2、AlCl3三种溶液,分别加入足量的硝酸银溶液,Cl-沉淀完全时,消耗等物质的量的AgNO3,则三种溶液的物质的量浓度之比为??????????????。
参考答案:(1)0.5,??0.2。?(2
本题解析:略
本题难度:一般
3、选择题 在托盘天平的两盘上,分别放有两个质量相同的烧杯,各盛有6mol/L HCl 100mL,使天平达到平衡。分别向两烧杯中加入不超过5g的镁和铝,若要使其充分反应后天平仍保持平衡,则加入的镁与铝的质量之比为(????)
A.1:1
B.24:27
C.12:9
D.32:33
参考答案:D
本题解析:
试题分析:依题意,n(HCl)=0.6mol,相对于5g的镁和铝,盐酸是过量的。
2HCl+Mg=MgCl2+H2???? Δm
24??????? 2?????? 22
a1???????????????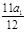
6HCl+2Al=2AlCl3+3H2??? Δm
54
本题难度:一般
4、填空题 (2分)常温常压下CO与H2等体积混合总质量为15g,则混合气体中H2的质量是?????????g。
参考答案:(2分)1g
本题解析:
试题分析:设氢气和CO的物质的量都是x,则根据n=m/M可知,28g/mol×x+2g/mol×x=15g,解得x=0.5mol。所以氢气的质量是2g/mol×0.5mol=1g。
点评:该题关键是根据阿伏加德罗定律得出氢气和CO的物质的量相等,然后依据条件列式计算即可。
本题难度:一般
5、选择题 设NA为阿伏伽德罗常数的值,下列说法正确的是(??)
A.1 L 0.25 mol/L的Na2SO4溶液中含氧原子个数为NA
B.12 g石墨烯(单层)中含六元环的个数为0.5 NA
C.78 g苯含有碳碳双键数为3 NA
D.电解精炼铜时每转移NA个电子,阳极溶解32 g铜
参考答案:B
本题解析:
试题分析:A、溶液中除了硫酸钠,还有大量的水,水中也含有氧,错误;B、十二克的石墨中碳原子的物质的量为一摩尔,而一个石墨的六元环含有二个碳原子,所以12 g石墨烯(单层)中含六元环的个数为0.5 NA,正确;C、苯分子中不含有双键,错误;D、电解精炼铜时每转移NA个电子,阳极溶解的铜小于32 g,因为阳极上的铜是不纯的,不完全是铜失电子,错误。
本题难度:一般