微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把aL含硫酸铵、硝酸铵的混合溶液分成两等份,一份用bmol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗cmolBaCl2,则原溶液中c(NO3-)为
A.mol?L-1
B.mol?1-1
C.mol?L-1
D.mol?L-1
参考答案:B
本题解析:分析:bmol烧碱刚好把NH3全部赶出,根据NH4++OH-═NH3+H2O可知每份中含有bmolNH4+,与氯化钡溶液完全反应消耗cmolBaCl2,根据Ba2++SO42-═BaSO4↓可知每份含有SO42-cmol.根据溶液不显电性,计算出每份中NO3-的物质的量,再根据浓度定义计算.
解答:bmol烧碱刚好把NH3全部赶出,根据NH4++OH-═NH3+H2O可知每份中含有bmolNH4+,
与氯化钡溶液完全反应消耗cmolBaCl2,根据Ba2++SO42-═BaSO4↓可知每份含有SO42-cmol.
令每份中NO3-的物质的量为n,根据溶液不显电性,则:
bmol×1=cmol×2+n×1
解得n=(b-2c)mol
每份溶液的体积为0.5aL,所以每份溶液硝酸根的浓度为c(NO3-)=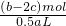 =
=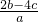 mol/L.
mol/L.
即原溶液中硝酸根的浓度为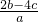 mol/L.
mol/L.
故选:B.
点评:本题考查学生利用离子方程式的简单计算,关键明确每份溶液中离子的物质的量浓度与原溶液的关系及溶液中的电荷守恒.
本题难度:一般
2、选择题 中国工业报2007年7月2日报道,国际投行瑞士信贷发布报告称,由于中国对铁矿石的需求增长超过预期,国际矿业巨头明年可能再度提高铁矿石售价的25%。下列有关铁及其化合物的说法中正确的是
A.赤铁矿的主要成分是Fe3O4
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤
D.Fe3+与KSCN产生红色沉淀
参考答案:C
本题解析:赤铁矿的主要成分是Fe2O3;铁与水蒸气在高温下的反应产物为Fe3O4和H2;铁离子遇KSCN溶液变为红色,但没有沉淀产生,一般可以用此方法检验铁离子的存在。
本题难度:简单
3、选择题 物质X是某反应中的生成物,其质量先增大后减小,下列各操作中指定物质数量变化符合此特征的是
A.A
B.B
C.C
D.D
参考答案:A
本题解析:分析:A、向NaClO溶液中通入SO2,生成的Na2SO3质量增大,继续通入生成亚硫酸氢钠;
B、向Na2CO3溶液中滴加盐酸,反应过程中氯化钠质量增多;
C、向NaHCO3溶液中滴加石灰水,开始生成碳酸钙和碳酸钠,继续滴加碳酸钠减小;
D、向KBr溶液中滴加稀氯水,反应过程中生成溴单质质量增大后不变.
解答:A、向NaClO溶液中通入SO2,生成的Na2SO4,继续通入质量不变,故A不符合;
B、向Na2CO3溶液中滴加盐酸,生成碳酸氢钠和氯化钠,继续滴加反应过程中氯化钠质量增多,故B不符合;
C、向NaHCO3溶液中滴加石灰水,开始生成碳酸钙和碳酸钠,继续滴加碳酸钠减小,故C符合;
D、向KBr溶液中滴加稀氯水,反应过程中生成溴单质质量增大后不变,故D不符合;
故选C.
点评:本题考查了钠及其化合物性质的应用,注意反应过程中量不同产物不同,物质性质是解题的关键,题目难度中等.
本题难度:一般
4、选择题 已知:
①向KClO3晶体中滴加浓盐酸,产生黄绿色气体.
②向NaI溶液中通入少量实验①产生的气体,溶液变黄色.
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.
下列判断正确的是
A.实验①证明Cl-具有还原性
B.实验②中氧化剂与还原剂的物质的量之比为2:1
C.实验③说明KI被氧化
D.上述实验证明氧化性:ClO3->Cl2>I2
参考答案:AD
本题解析:分析:①向KClO3晶体中滴加浓盐酸,产生黄绿色气体,应为Cl2,说明Cl-被氧化,发生KClO3+6HCl=3Cl2↑+KCl+3H2O;
②向NaI溶液中通入少量实验①产生的气体,溶液变黄色,生成I2,可使淀粉KI试纸变蓝,发生2I-+Cl2=I2+2Cl-,
氧化还原反应中,氧化剂+还原剂=氧化产物+还原产物,氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物,以此解答该题.
解答:A.向KClO3晶体中滴加浓盐酸,产生黄绿色气体,应为Cl2,发生KClO3+6HCl=3Cl2↑+KCl+3H2O,说明Cl-被氧化,证明Cl-具有还原性,故A正确;
B.向NaI溶液中通入少量实验①产生的气体,溶液变黄色,生成I2,可使淀粉KI试纸变蓝,发生2I-+Cl2=I2+2Cl-,氧化剂与还原剂的物质的量之比为1:2,故B错误;
C.向NaI溶液中通入少量实验①产生的气体,溶液变黄色,生成I2,可使淀粉KI试纸变蓝,但KI没有被氧化,故C错误;
D.根据氧化剂+还原剂=氧化产物+还原产物,氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物,则由反应①可知氧化性KClO3>Cl2,由反应②可知Cl2>I2,则可得氧化性ClO3->Cl2>I2,故D正确.
故选D.
点评:本题考查氯气的化学性质,题目难度不大,在学习中要注意比较氧化性、还原性的方法,氧化还原反应电子守恒的利用等问题.
本题难度:一般
5、选择题 下列反应的离子方程式正确的是
A.Fe203溶于过量的氢碘酸中:Fe203+6H+=2Fe3++3H2O
B.向?NaAl02溶液中通入过量CO2:AlO2-+C02+2H2O=Al(OH)3↓+HCO3-
C.向漂白粉溶液中通入S02气体:Ca2++2ClO-+S02+H2O=CaSO3↓+2HCl0
D.向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H20
参考答案:BD
本题解析:分析:A、氢碘酸具有还原性可以被三价铁氧化为碘单质;
B、偏铝酸钠溶液中通入过量二氧化碳生成氢氧化铝沉淀和碳酸氢钠;
C、次氯酸具有强氧化性氧化亚硫酸钙为硫酸钙;
D、硝酸亚铁具有还原性在酸性溶液中被稀硝酸氧化为铁离子.
解答:A、氢碘酸具有还原性可以被三价铁氧化为碘单质,反应的离子方程式为Fe203++2I-+6H+=2Fe2++3H2O+I2,故A错误;
B、偏铝酸钠溶液中通入过量二氧化碳生成氢氧化铝沉淀和碳酸氢钠,AlO2-+C02+2H2O=Al(OH)3↓+HCO3-,故B正确;
C、次氯酸具有强氧化性氧化亚硫酸钙为硫酸钙,Ca2++2ClO-+S02+H2O=CaSO4↓+2Cl-+2H+,故C错误;
D、硝酸亚铁具有还原性在酸性溶液中被稀硝酸氧化为铁离子,3Fe2++4H++NO3-=3Fe3++NO↑+2H20,故D正确;
故选BD.
点评:本题考查了离子方程式的书写方法和注意问题,掌握物质性质是解题关键,题目难度中等.
本题难度:简单