微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是( )
A.氯化钠溶液在电流作用下电离成钠离子和氯离子
B.溶于水后能电离出氢离子的化合物都是酸
C.硫酸钡难溶于水,但硫酸钡属于强电解质
D.二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
参考答案:A.氯化钠溶液在水分子的作用下电离成钠离子和氯离子,无须通电
本题解析:
本题难度:一般
2、选择题 下列电离方程式中书写正确的是
A.NaHSO4 Na++H++SO42-
Na++H++SO42-
B.NaHCO3 Na++H++CO32-
Na++H++CO32-
C.HClO = H++ClO-
D.H2S  H++HS-;HS-
H++HS-;HS- H++S2-
H++S2-
参考答案:D
本题解析:本题属于较易题,考察的是电离方程式书写的规则,A选项错误,强酸酸式盐的电离,应为完全电离,用=表示,应为NaHSO4 =Na++H++SO42-
B选项错误, 弱酸酸式盐的电离,应为完全电离,用=表示,弱酸酸式根离子不能拆开写,应为NaHCO3 =Na++HCO3-
C选项错误,弱电解质电离为部分电离,用 本题难度:简单
本题难度:简单
3、选择题 下列物质中属于电解质的是( )
A.葡萄糖
B.三氧化硫
C.碳酸钠
D.氨水
参考答案:A、葡萄糖在熔融状态下和水溶液中都不导电,所以葡萄糖为非电解
本题解析:
本题难度:简单
4、填空题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表
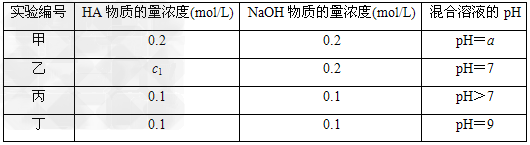
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸:_________________________________________________.
(2)不考虑其他组的实验结果,单从乙组情况分析,c1________等于0.2?mol/L(“一定”或“不一定”).混合溶液中离子浓度c(A-)与c(Na+)的大小关系是________(填字母序号).
A.前者大?? B.后者大 C.二者相等?? D.无法判断
(3)从丙组实验结果分析,HA是________酸(“强”或“弱”),该混合溶液中离子浓度由大到小的顺序是___________________________.
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________?mol/L.写出该混合溶液中c(Na+)-c(A-)=________?mol/L的精确结果(不能做近似计算,回答准确值,结果不一定要化简).
参考答案:(1)a=7时,HA是强酸,a
本题解析:
本题难度:一般
5、选择题 向某溶液中滴加BaCl2溶液,产生白色沉淀,继续滴加HCl溶液,沉淀不溶解.该溶液中存在
A.
B.Ag+
C.
D.或Ag+
参考答案:D
本题解析:分析:能和氯化钡溶液发生反应生成的白色沉淀可以是:氯化银、硫酸钡、碳酸钡、亚硫酸钡等,其中的氯化银、硫酸钡是白色不溶于盐酸的沉淀.
解答:某溶液中滴入BaCl2溶液,产生白色沉淀,白色沉淀可以是:氯化银、硫酸钡、碳酸钡、亚硫酸钡等,再滴入稀盐酸,沉淀不溶解,则一定不含有碳酸钡、亚硫酸钡沉淀,至少含有氯化银和硫酸钡中的一种,即溶液中含有SO42-、Ag+中的至少一种.
故选D.
点评:本题考查学会能和钡离子、氯离子反应生成白色沉淀的离子,可以根据教材知识来回答,注意知识的归纳,难度不大.
本题难度:一般