微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向氨水中加入NH4Cl晶体,溶液的碱性
A.增强
B.减弱
C.不变
D.为零
参考答案:B
本题解析:氨水中存在如下平衡平衡: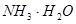 ?
?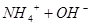 ,所以
,所以
加入NH4Cl晶体,溶液中铵根离子浓度增大,平衡逆向移动,溶液的碱性减弱;
本题难度:一般
2、选择题 在100mL0.1mol/L 的醋酸溶液中,欲使醋酸的电离度增大,H+ 浓度减小,可采用的方法是(???)?????
A.加热
B.加入0.1mol/L 的醋酸溶液100mL
C.加入少量的0.5mol/L的硫酸
D.加入少量的1mol/L 的NaOH溶液
参考答案:D
本题解析:加入氢氧化钠,与醋酸电离出的H+反应,使其减少,促进醋酸的电离。
本题难度:简单
3、选择题 将H+浓度相同,溶液体积也相同的两种酸溶液(甲:盐酸;乙:醋酸)分别与锌反应,若最后有一 溶液中有锌剩余,且放出的气体一样多,对此有如下判断:
(1)反应所需时间乙<甲(2)开始时反应速率甲>乙(3)参加反应的锌的质量甲=乙(4)整个反应阶段的平均速率乙>甲(5)盛盐酸的容器中有锌剩余(6)盛醋酸的容器中有锌剩余
以上判断正确的是(??? )
A.(1)(2)(3)(5)
B.(1)(3)(5)
C.(2)(3)(6)
D.(1)(3)(4)(5)
参考答案:D
本题解析:盐酸是强酸,醋酸是弱酸,当两者H+浓度相同时,醋酸浓度比盐酸浓度大得多。依题意与锌反应放出的氢气一样多,则参加反应的锌以及参加反应的酸一样多,故盐酸反应完,醋酸有剩余。盐酸中有锌剩余。由于两者H+浓度相同所以开始反应速率相等,但由于醋酸存在电离平衡,当H+浓度减小时平衡右移补充H+浓度,故反应较快。
本题难度:简单
4、选择题 已知25℃时有关弱酸的电离平衡常数如下表:
弱酸化学式
| HX
| HY
| H2CO3
|
电离平衡常数
| 7.8╳10-9
| 3.7╳10-15
| K1=4.3╳10-7
K2=5.6╳10-11
下列推断正确的是
A.这两种弱酸的酸性HX>HY
B.相同条件下溶液的碱性NaX>Na2CO3>NaY>NaHCO3
C. 结合H+的能力:CO32->Y->X->HCO3-
D.HX和HY酸性相同,都比H2CO3弱
参考答案:A
本题解析:弱酸的电离平衡常数越大,表明该弱酸的酸性相对较强,所对应的盐水解程度越小;
即酸性强弱关系:H2CO3>HX>HCO3—>HY;即A正确;B错,相同条件下溶液的碱性NaY>Na2CO3>NaX>NaHCO3;C错,结合H+的能力:Y->CO32->X->HCO3-;
D错,HX和HY酸性不相同,但都比H2CO3弱
本题难度:一般
5、选择题 一定温度下,用水稀释c mol·L-1的稀醋酸,若用KW表示水的离子积,则下列数值随水量的增加而增大的是(?)
A.c(CH3COO-)/c(CH3COOH)
B.c(CH3COOH)/c(H+)
C.c(H+)/c(OH-)
D.c(H+)/KW
参考答案:A
本题解析:醋酸属于弱电解质,存在电离平衡:CH3COOH CH3COO-+H+。稀释促进电离,即n(CH3COOH)减小,n(CH3COO-)、n(H+)增加,所以酸性会降低,相应的碱性会增强,即c(H+)减小,c(OH-)增大,所以选项C减小。水的离子积只与温度有关,稀释时不变,因此选项D也减 CH3COO-+H+。稀释促进电离,即n(CH3COOH)减小,n(CH3COO-)、n(H+)增加,所以酸性会降低,相应的碱性会增强,即c(H+)减小,c(OH-)增大,所以选项C减小。水的离子积只与温度有关,稀释时不变,因此选项D也减
本题难度:一般
|