微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某稀溶液中含有Fe (NO3) 3、Cu (NO3) 2、HNO3,向其中逐渐加人铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图4所示。则溶液中Fe(NO3)3、Cn( NO3)2、HN03物质的量浓度之比为

A.1:1:1
B.1:3:1
C.3: 3: 8
D.1:1:4
参考答案:D
本题解析:本题一定要注意铁粉与三者的反应顺序(考查了常见氧化剂的氧化性顺序):
Fe+4HNO3=Fe(NO3)3+NO↑+H2O
1???? 4????? 1(均以mol为单位)
2Fe(NO3)3+Fe=3FeNO3
1+1???????? 1??? 3
Cu(NO3)2+Fe=Fe(NO3)2+Cu
1?????????? 1?? 1
故溶液中Fe(NO3)3、Cn( NO3)2、HN03物质的量浓度之比为1:1:4
本题难度:一般
2、选择题 将Fe、Cu、Fe2+、Fe3+和Cu2+盛于同一容器中充分反应,如Fe有剩余,则容器中只能有
A.Cu、Fe3+
B.Fe2+、Fe3+
C.Cu、Fe2+、Fe
D.Cu、Cu2+、Fe
参考答案:C
本题解析:略
本题难度:简单
3、选择题 (多选)由5mol ?、4mol
?、4mol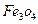 和3mol Fe0组成的混合物,加入纯铁1mol并在高温下和
和3mol Fe0组成的混合物,加入纯铁1mol并在高温下和 反应。若纯铁完全反应,则反应后混合物中Fe0与
反应。若纯铁完全反应,则反应后混合物中Fe0与 的物质的量之比可能是
的物质的量之比可能是
A 4:3??? R.3:2??? C,3:1??? D.2:l
参考答案:BC
本题解析:略
本题难度:一般
4、选择题 向一定量的Cu、Fe2O3的混合物中加入300 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+。若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为?? ( )。
A.6.4 g
B.4.8 g
C.2.4 g
D.1.6 g
参考答案:C
本题解析:向混合物中加入盐酸时发生如下反应:Fe2O3+6HCl=2FeCl3+3H2O、2FeCl3+Cu=CuCl2+2FeCl2,由题意可知:Cu与Fe2O3的物质的量相等,设二者的物质的量均为x,则有6x=0.3 L×1 mol·L-1=0.3 mol,x=0.05 mol;若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量即为氧原子的质量:0.05 mol×3×16 g·mol-1=2.4 g。
本题难度:一般
5、实验题 孔雀石的主要成分为Cu2(OH)2CO3,还含少量铁的氧化物和硅的氧化物。以下是实
验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图:

(1)研磨孔雀石的目的是????????????????????????????????????????????????????。浸泡孔雀石的试剂A若选用过量的稀硫酸,则固体a是?????????(填化学式)。
(2)试剂B的目的是将溶液中的Fe2+转化为Fe3+,则试剂B宜选用?????(填序号):
A.酸性KMnO4溶液???? B.双氧水??? C.浓硝酸??? D.氯水
相应的离子方程式为:????????????????????????????????????。
(3)试剂C用于调节溶液pH,使Fe3+转化为沉淀予以分离。则试剂C宜选用???(填序号):
A.稀硫酸??????? B.NaOH溶液?????? C.氨水???? D.CuO
固体C的化学式为?????????。
(4)1 mol氨气通过加热的Cu2(OH)2 CO3可以产生1.5 mol金属铜,则该反应的化学方程式为??????????????????????????????????????????????????????。
(5)常温下Fe(OH)3的Ksp=1×10-39,若要将溶液中的Fe3+转化为Fe(OH)3沉淀,使溶液中c(Fe3+)降低至1×10—3 mol/L,必需将溶液调节至pH=?????。
参考答案:(1)(共4分)增大固体表面积(1分),以增大反应速率(1分
本题解析:
试题分析:(1)研磨孔雀石的目的是为了酸溶速率更快,所以答案为“增大固体接触面积,加快反应速率”,酸溶过程中不溶的固体为杂质SiO2。
(2)把Fe2+转化为Fe3+ 应该加入氧化剂,且不能带入杂质离子,所以用双氧水,选B。相应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O。
(3)因为目标产品是CuSO4·5H2O晶体,所以调节pH值使铁离子沉淀应选用的试剂不能带入杂质离子,所以选用固体CuO,所以沉淀物c为Fe(OH)3 和过量的CuO。
(4)碱式碳酸铜
本题难度:一般