微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 钯(Pd)元素的原子序数为46,下列叙述错误的是[???? ]
A.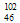 Pd和
Pd和 Pd互为同位素????
Pd互为同位素????
B.钯是第五周期元素
C.Pd2+核外有48个电子???? ????
D.?Pd的原子核内有62个中子
参考答案:C
本题解析:
本题难度:简单
2、选择题 几种短周期主族元素的结构与性质信息如下表:
A.X的气态氢化物一定比T的气态氢化物稳定
B.Y单质与T单质不可直接按原子个数1:1化合
C.常温下Z单质能溶于X最高价氧化物对应水化物的浓溶液中
D.一定条件下元素T或X的氢化物可分别与其氧化物反应生成T或X单质
参考答案:D
本题解析:由表格中信息可知:T为O或S;氢化物水溶液呈碱性只有NH3,故X为N;原子半径最大同周期从左到右在减小,从上到下在增大,所以短周期中原子半径最大的是Na;元素最高正价是+3价其最高价氧化物可做耐火材料为Al。若T为O非金属大于N对应气态氢化物更稳定,A错误;N和O可以形成NO,B错误;氨水是弱碱与Al不反应,C错误;答案选D。
本题难度:简单
3、选择题 下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是

A.原子半径:Z>Y>X
B.气态氢化物的稳定性:RC.WX3和水反应生成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
参考答案:D
本题解析:试题分析:由表中化合价可知,X的化合价为-2价,没有正化合价,故X为O元素。Y的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Z为Na元素。Z为+3价,为Al元素。W的化合价为+6、-2价,故W为S元素,R的化合价为+7、-1价,故R为Cl元素。则A、X、Y、Z、W、R分别为O、Na、Al、S、Cl,同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,因此原子半径的顺序应为Y>Z>W>R>X,故A错误;B、非金属性越强,氢化物的稳定性越强。非金属性Cl>S,故氢化物稳定性HCl>H2S,故B不正确;C、SO3和水反应生成硫酸,硫酸是共价化合物,C不正确;D、Al(OH)3具有两性,可与NaOH溶液反应生成偏铝酸钠和水,故D正确,答案选D。
考点:考查元素周期律应用、化学键、化合物判断以及氢氧化铝性质等
本题难度:困难
4、填空题 在1~18号元素中,除稀有气体元素外:
(1)原子半径最大的元素是______,原子半径最小的元素是______.
(2)单质的还原性最强的元素是______,单质的氧化性最强的元素是______.
(3)形成化合物种类最多的元素是______.
参考答案:(1)同一周期元素从左到右元素的原子半径逐渐减小,同主族元素
本题解析:
本题难度:一般
5、填空题 F表为长式周期表的一部分,其中的编号代表对应的元素

请回答下列问题:
(1)表中属于d区的元素是____(填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种常见环状分子名称为____;③和⑦形成的常见化合物类型是_______(填“离子”或“共价”)化合物。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子数为____个。
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:__________________。
参考答案:(1)⑨
(2)苯;共价
(3)2
本题解析:
本题难度:一般