微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 NH4Cl稀溶液中分别加入少量下列物质或改变如下条件,能使比值c(NH4+)/c(Cl—)一定增大的是
①HCl气体 ②氨气 ③H2O ④NH4Cl固体 ⑤NaOH固体 ⑥降温
A.③④⑤
B.②④
C.②③⑥
D.②④⑥
参考答案:D
本题解析:氯化铵中存在水解平衡,NH4Cl+H2O NH3·H2O+HCl。通入氯化氢,则抑制水解,但比值是减小的;通入氨气,抑制水解,比值增大;稀释促进水解,比值减小;加入氯化铵固体,抑制水解,比值增大;氢氧化钠固体促进水解,比值减小;水解吸热,降低温度,抑制水解,比值增大,因此正确的答案选D。
NH3·H2O+HCl。通入氯化氢,则抑制水解,但比值是减小的;通入氨气,抑制水解,比值增大;稀释促进水解,比值减小;加入氯化铵固体,抑制水解,比值增大;氢氧化钠固体促进水解,比值减小;水解吸热,降低温度,抑制水解,比值增大,因此正确的答案选D。
本题难度:一般
2、选择题 下列物质中,能发生水解反应的是( )
A.苯
B.乙酸
C.淀粉
D.葡萄糖
参考答案:C
本题解析:
本题难度:一般
3、选择题 能正确表示下列反应的离子方程式是
A.NaHCO3的水解:HCO3-+H2O=CO32-+H3O+
B.用银氨溶液检验乙醛的醛基:
CH3CHO+2Ag(NH3)2OH CH3COO-+NH4++3NH3+2Ag↓+H2O
CH3COO-+NH4++3NH3+2Ag↓+H2O
C.向苯酚钠溶液中通入少量的CO2:CO2+H2O+2C6H5O- 2C6H5OH+2CO32-
2C6H5OH+2CO32-
D.泡沫灭火剂的原理:Al3++3HCO3-=Al(OH)3↓+3CO2↑
参考答案:D
本题解析:
试题分析:A、HCO3?少量水解,应该用“ ”,错误;B、Ag(NH3)2OH为强电解质,应该用离子符号表示,错误;C、向苯酚钠溶液中通入少量的CO2,生成C6H5OH和HCO3?,错误;D、泡沫灭火剂的原理是Al3+与HCO3?的相互促进的完全水解反应,正确。
”,错误;B、Ag(NH3)2OH为强电解质,应该用离子符号表示,错误;C、向苯酚钠溶液中通入少量的CO2,生成C6H5OH和HCO3?,错误;D、泡沫灭火剂的原理是Al3+与HCO3?的相互促进的完全水解反应,正确。
考点:本题考查离子方程式的书写。
本题难度:一般
4、选择题 25℃时,将一定浓度的盐酸和一定浓度的氨水按2∶1 的体积比混合,若混合溶液中c(NH4+)=c(Cl-),则溶液的pH
A.大于7
B.小于7
C.等于7
D.无法确定
参考答案:C
本题解析:
试题分析:
混合溶液中根据电荷守恒,得c(NH4+)+ c(H+)=c(Cl-)+ c(OH-),已知c(NH4+)=c(Cl-),可得c(H+)=c(OH-),25℃时,混合溶液等于7。
考点:考查电荷守恒
点评:本题考查了盐类水解、电荷守恒,难度不大。解题时注意电荷守恒的应用。
本题难度:一般
5、填空题 (18分)研究SO2、NOx、CO等气体的性质对工业生产和环境保护具有重要意义。
(1)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为________________,所得溶液中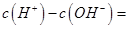 _________ (填字母编号)。
_________ (填字母编号)。
(2)通过NOx传感器可监测大气中NOx的含量,其工作原理如图所示,甲、乙两电极均Pt电极,电解质为熔融氧化物。
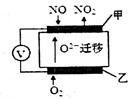
①乙电极上发生的是_________反应(填“氧化”或“还原”);
②甲电极上的电极反应式为___________________。
(3)将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g) CO2(g)+H2(g) △H,得到如下数据:
CO2(g)+H2(g) △H,得到如下数据:
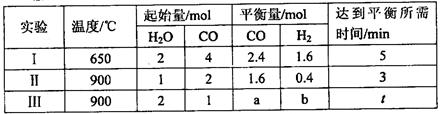
①由表中数据可知该反应的△H________ 0(填“>”或“<”)。
②650℃时,若在此容器中开始充入2mol H2O(g)、lmol CO、1 mol CO2和2 molH2,则反应在开始时_________进行(填“正向”或“逆向”)。
③实验III中a=______,达平衡时实验II和实验III中H2O(g)的转化率的大小关系为: (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
参考答案:(18分)
(1)SO2+NH3+H2O===NH4+
本题解析:
试题分析:(1)相同物质的量的SO2与NH3溶于水生成NH4HSO3,所以离子方程式为:SO2+NH3+H2O===NH4++HSO3-;根据电荷守恒可得:c(H+)+c(NH4+)=c(OH?)+c(HSO3?)+2c(SO32?),所以c(H+)—c(OH?)= +c(HSO3?)+2c(SO32?)—c(NH4+),根据物料守恒可得:c(NH4+)+c(NH3?H2O)=c(HSO3?)+c(H2SO3)+c(SO32?),与电荷守恒式相减可得:c(H+)—c(OH?)=c(SO32?)+c(NH3?H2O)—c(H2SO3),故答案为BD。
(2)①根据O22?移动方向可知乙为原电池的正极,发生还原反应。
②根据示意图可知NO在甲电极上与O2?反应生成NO2,电极方程式为:NO-2e-+O2-===NO2。
(3)①对比实验I与实验II数据可知,温度升高,CO的转化率减小,所以正反应为放热反应,故?H < 0。
②根据表中650℃时数据可知:H2O(g)+CO(g)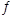 CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度(mol?L?1) 1 2 0 0
转化浓度(mol?L?1) 0.8 0.8 0.8 0.8
平衡浓度(mol?L?1) 0.2 1.2 0.8 0.8
则650℃时平衡常数K=0.8×0.8/(0.2×1.2)=2.67,充入2mol H2O(g)、lmol CO、1 mol CO2和2 molH2,浓度商Q==0.5×1/(1×0.5)="1" < K,所以开始时反应向正反应方向进行。
③根据表中反应II的数据,CO、H2O的转化量为0.4mol,则反应III的转化量也是0.4mol,所以平衡时a=1mol—0.4mol=0.6mol;实验II中H2O的初始量为1mol、CO的初始量为2mol,实验III中H2O的初始量为2mol、CO的初始量为1mol,所以实验IIH2O的转化率大于实验III。
考点:本题考查离子浓度比较、原电池原理、化学平衡常数、化学平衡。
本题难度:困难