微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应达到平衡后增大压强或升高温度,平衡都向正反应方向移动的是[???? ]
A.2NO2 N2O4 (正反应放热)
N2O4 (正反应放热)
B.NH4HCO3(s) NH3+H2O(g)+CO2 (正反应吸热)
NH3+H2O(g)+CO2 (正反应吸热)
C.H2(g)+I2(g)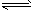 2HI(g) (正反应放热)
2HI(g) (正反应放热)
D.3O2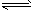 2O3(正反应为吸热反应)
2O3(正反应为吸热反应)
参考答案:D
本题解析:
本题难度:一般
2、填空题 固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)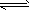 CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1 某同学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1 某同学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
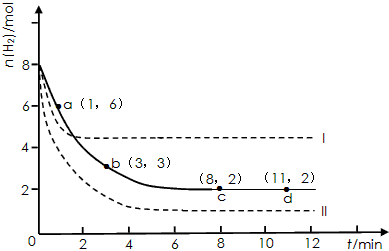
(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是___________。
A.0~1min B.1~3min C.3~8min D.8~11min
(3)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是___________,曲线II对应的实验条件改变是___________。
参考答案:(1)大于
(2)A
(3)升高温度;增大压强
本题解析:
本题难度:一般
3、填空题 SO2随意排放会造成严重的大气污染。下列是某小组同学设计处理烟气(主要含SO2、N2、O2、粉尘)中SO2的方法。
(1)方法一:利用氯碱工业产品处理含SO2的烟气,流程如下

①“吸收装置”中发生反应的离子方程式是____________________;
②上述流程中循环利用的一种物质是__________________。
(2)方法二:利用FeCl3溶液的氧化性吸收烟气中的SO2。
①?该反应的离子方程式是___________________(反应a)。为验证该反应,同学们将SO2通入0.05?mol·L-1?FeCl3溶液中,溶液很快由黄色变为红褐色;将溶液长时间放置后,最终变为浅绿色。关于红褐色液体,以下是同学们的分析推测与实验。

②?利用胶体的__________(填性质)可以检验步骤ⅰ中是否得到了Fe(OH)3胶体;
③?根据反应b,说明步骤ⅱ中液体颜色变化的原因是_____________________(用离子方程式及必要的文字说明)。
④?经讨论后得出结论:FeCl3溶液和SO2反应过程中,反应a、b在体系中共存。原因是由于化学反应速率:b>a,化学反应限度:a>b,所以产生上述现象。?
参考答案:(1)① SO2+OH-=HSO3-;②NaCl溶液
本题解析:
本题难度:一般
4、选择题 如图所示:等温时,a、b容器开始体积相等,各充入等量的SO3(g),则平衡时SO3的转化率大小关系是( )
A.a>b
B.a<b
C.a=b
D.无法确定
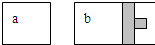
参考答案:充入SO3(g)后发生反应2SO3(g)?2SO2(g)+O
本题解析:
本题难度:简单
5、填空题 在恒温恒容的条件下,发生H2(g)+I2(g)?2HI(g),已知①②③的平衡状态中,HI%相同,填写表中的空白:
| 编号 | ?起始状态(mol) | ?平衡时HI的物质的量(mol)
?H2
?I2
?HI
?已知
?1
?2
?0
?a
?①
?2
?4
?0
?
______
?②
?
______
?
______
?1
?0.5a
?③
?m
?n(n≥2m)
?
______
?
______
参考答案:恒温恒容下,发生H2(g)+I2(g)?2HI(g),该反应
本题解析:
本题难度:一般
|