微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 降低大气中CO2的含量、减缓温室效十分重要。
(1)工业上有一种方法是用CO2来生产甲醇:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)

上图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。该反应是 (填“吸热”或“放热”)反应。
(2)某温度下,若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如下图实线所示。则加入催化剂的曲线是 (填:a或b);
0—8min内该反应的平均速率v(CO2)= mol/(L·min)。

(3)在CO跟O2的反应中,破坏1molCO中的化学键消耗的能量为a kJ,破坏1molO=O键消耗的能量为bkJ,形成1molC=O键释放的能量为ckJ。则1molCO在空气中完全燃烧生成CO2放出的能量为
kJ。
参考答案:(1)(1分)放热 (2)(2分)b&
本题解析:
试题分析:(1)由图可知该反应物总能量大于生成物总能量,该反应为放热反应。
(2)催化剂只能改变反应的活化能,加快反应速率,不改变反应物和生成物的能量即不改变反应热,所以加入催化剂的曲线为b
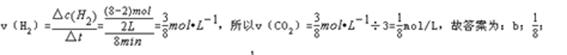
(3)焓变值等于反应物见呢过和减去生成物键能和等于a减去二分之一b减去2c,放热反应的焓变值小于0,所以放出的热量为2c-(a+b/2)
考点:考查化学反应速率的计算,反应热与焓变,活化能等相关知识点。
本题难度:一般
2、填空题 (5分)用相关的化学用语表示下列物质:
⑴ 写出电子式Al3+?????????????Cl ???????????????
⑵ 写出下列物质的结构式:N2 ???????????????????CO2???????????????????
⑶ 用电子式表示NaOH_______________________
参考答案:略
本题解析:
试题分析:(1)电子式是在元素符号周围用×或点表示元素原子的最外层电子,故阳离子Al3+本身就是它的电子式,氯原子最外层有7个电子,在Cl元素符号周围写上7个电子即为电子式;(2)氮气分子中存在氮氮三键,故结构式为:N≡N;二氧化碳中碳和氧之间是碳氧双键,故结构式为:O=C=0;(3)离子化合物的电子式表示出阳离子和阴离子,钠离子的电子式就是钠离子本身,写上氢氧根离子的电子式即得氢氧化钠的电子式。
本题难度:一般
3、选择题 通过复习总结下列归纳正确的是[???? ]
A.Na2O、NaOH、Na2CO3、NaCl、Na2SO4、Na2O2都属于钠的含氧化合物
B.简单非金属阴离子只有还原性,金属阳离子不一定只有氧化性
C.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
D.物质发生化学变化一定有化学键断裂与生成,并伴有能量变化,而发生物理变化就一定没有化学键断裂与生成,也没有能量变化
参考答案:B
本题解析:
本题难度:简单
4、选择题 中和热测定实验中,下列操作会使测得的△H数值偏大的是
A.大烧杯上没有盖硬纸板
B.用环形铜丝搅拌棒代替环形玻璃搅拌棒
C.用相同浓度和体积的硝酸代替稀盐酸溶液进行实验
D.用1gNaOH固体代替50mL0.5mol/L的NaOH溶液进行实验
参考答案:D
本题解析:A和B均会使反应中放出的热量损失,从而使测得的反应热偏小。C不影响。D中氢氧化钠固体溶于水会放热,因此测得的反应热偏大。答案选D。
本题难度:简单
5、选择题 下列事实中,能够证明HCl是共价化合物的是
A.HCl易溶于水
B.液态的HCl不导电
C.HCl不易分解
D.HCl溶于水能电离,呈酸性
参考答案:B
本题解析:
试题分析:共价化合物的构成微粒不带电,则液态不导电。但离子化合物的构成微粒带电,其液态能导电,以此来证明氯化氢是共价化合物。
A、不能利用溶解性判断是否为共价化合物,如NaCl也易溶于水,但属于离子化合物,故A错误;
B、因共价化合物的构成微粒不带电,离子化合物的构成微粒带电,则可利用液态氯化氢不导电来证明氯化氢是共价化合物,故B正确;
C、不能利用分解来判断是否为共价化合物,如NaCl受热也不易分解,但属于离子化合物,故C错误;
D、氯化氢溶于水,溶液显酸性,不能作为判断
本题难度:简单
[-page- ]
1、选择题 已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
[???? ]
A.920 kJ
B.557 kJ
C.436 kJ
D.188 kJ
2、选择题 断裂下列化学键需要吸收的能量分别为:H-H:436 kJ/mol F-F:153 kJ/mol H-F:565 kJ/mol,下列说法正确的是( )
A.H2与F2反应的热化学方程式为:
H2(g)+F2(g)=2HF(g) ΔH=-541 kJ
B.2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量
C.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于541 kJ
D.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
3、选择题 下列分子的中心原子的杂化类型与其他不同的是
A.SiCl4
B.H2S
C.PCl5
D.NH3
4、填空题 (14分)
“神七”登天标志着我国的航天事业进入了新的篇章。
(1)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。已知:
N2(g) + 2O2(g) =2NO2(g)?????????? △H =" +67.7" kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g)?? △H = -534.0 kJ·mol-1
NO2(g)  1/2N2O4(g)??????????????? △H = -26.35 kJ·mol-1
1/2N2O4(g)??????????????? △H = -26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
_______________________________________________________________________。
(2)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,
燃料电池放电时的负极反应为:___________________________________。
如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标况),则该段时间内水电解系统中转移电子的物质的量为______________mol。

(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH——4e— = O2↑+2H2O,则阴极反应为:____________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行?_______,理由是:___________________________________。
5、填空题 已知下列热化学方程式:
①CaCO3(s) CaO(s)+CO2(g) ΔH=+177.7 kJ
CaO(s)+CO2(g) ΔH=+177.7 kJ
②C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
③HCl(l)+NaOH(l) NaCl(l)+H2O(l) ΔH=-57.3 kJ·mol-1
NaCl(l)+H2O(l) ΔH=-57.3 kJ·mol-1
④C(s)+O2(g) CO2(g) ΔH=-393.5 kJ·mol-1
CO2(g) ΔH=-393.5 kJ·mol-1
⑤CO(g)+O2(g) CO2(g) ΔH="-283" kJ·mol-1
CO2(g) ΔH="-283" kJ·mol-1
⑥2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ·mol-1
2H2O(l) ΔH=-571.6 kJ·mol-1
(1)上述热化学方程式中,不正确的有 。
(2)上述反应中,表示燃烧热的热化学方程式有 。