微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)按要求写出对应的方程式:
1)H++HCO3- = H2O+CO2↑(写出符合该离子反应的两种不同类型的化学方程式)
; 。
2)KAl(SO4)2在水溶液中的电离方程式: 。
3)铝片与硝酸汞溶液反应的离子方程式:  。
。
参考答案: 本题解析:略
本题解析:略
本题难度:一般
2、填空题 按要求完成下列化学用语:
(1)NaHSO4的电离方程式: ,
(2)CuSO4溶液和NaOH溶液反应的离子方程式: ,
(3)能用H++OH-=H2O表示的一个化学方程式: 。
参考答案:(1)NaHSO4 = Na+ + H+ + SO42-&#
本题解析:
试题分析:(1)、NaHSO4为强酸的酸式盐,在水溶液中完全电离,电离方程式为NaHSO4 = Na+ + H+ + SO42- ;(2)、CuSO4+2NaOH= Cu(OH)2↓+Na2 SO4,将其拆为离子方程式即为Cu2+ + 2OH- = Cu(OH)2↓(3)、H++OH-=H2O,表示强酸和强碱反应生成可溶性的盐和水的反应,如HCl + NaOH =" NaCl" + H2O
考点:电离方程式和离子方程式的书写
本题难度:一般
3、选择题 下列离子方程式书写正确的是
A.H218O中投入Na2O2固体:2H218O+2Na2O2===4OH-+4Na++18O2↑
B.Fe3O4与稀HNO3反应:Fe3O4+8H+===Fe2++2Fe3++4H2O
C.向NaHCO3溶液中加入少量Ca(OH)2:HCO3-+Ca2++OH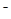 ===CaCO3↓+H2O
===CaCO3↓+H2O
D.将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO3-===CO32-+H2O
参考答案:D
本题解析:
试题分析:A、过氧化钠与水的反应中,过氧化钠既是氧化剂又是还原剂,所以水分子中的O原子的同位素不可能转化为氧气,错误;B、稀硝酸具有强氧化性,所以四氧化三铁与稀硝酸反应铁元素全部转化为铁离子,错误;C、氢氧化钙少量时,则参加反应的氢氧根离子与钙离子的个数比为2:1,错误;D、氢氧化钠少量时,碳酸氢根离子先与氢氧根离子反应生成碳酸根离子和水,正确,答案选D。
考点:考查离子方程式书写正误的判断
本题难度:一般
4、填空题 (10分)将1mol/L的FeCl3溶液逐滴滴入沸水中,液体变为 色,得到的是 ;反应的化学方为 。向其中逐滴加入稀硫酸至过量,现象是 ,原因是 。
参考答案:(10分)红褐 Fe(O
本题解析:
试题分析:实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和的氯化铁溶液,当液体变成红褐色时立即停止加热,向氢氧化铁胶体中逐滴加入稀硫酸至过量,胶体遇电解质会发生聚沉,聚沉后,氢氧化铁与硫酸反应生成可溶性的硫酸铁,所以答案为:红褐 Fe(OH)3胶体 FeCl3+3H2O==Fe(OH)3(胶体)+3HCl 先出现红褐色沉淀,后沉淀消失 先聚沉,后溶解。
考点:考查氢氧化铁胶体的制备,性质等知识。
本题难度:一般
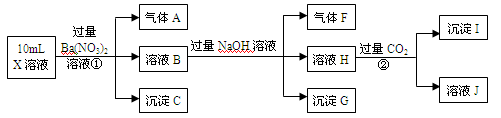
5、填空题 (9分)某强酸性溶液X中可能含有H+、A13+、NH4+、Fe2+、CO32-、SO42-、C1-、NO3- 中的若干种。某研究性小组为了探究其成分,进行了如下实验:
请回答下列问题:
(1)沉淀C的化学式为 ,气体A的化学式为 。
(2)写出向溶液H中通入过量CO2气体生成沉淀I的离子方程式: 。
(3)通常可以利用KClO在KOH溶液中氧化沉淀G来制备一种新型、高效、多功能水处理剂K2MO4。(M为G中的一种元素,K2MO4易溶于水)请写出制备过程中的离子方程式(M用具体的元素符号表示) 。
(4)无法确定的离子是 ,请设计实验验证该离子是否存在的方法 。
参考答案:(1)BaSO4 NO (各1分)(2
本题解析:
试题分析:溶液显强酸性,则一定不存在碳酸根离子,存在氢离子。混合液中加入过量硝酸钡溶液,产生气体A、溶液B和沉淀C,这说明溶液中一定有还原性离子在酸性溶液中被硝酸根氧化,因此一定含有亚铁离子。在强酸性溶液中硝酸根能氧化亚铁离子,则硝酸根一定不存在,气体A是NO,C是硫酸钡,所以含有硫酸根离子。B中加入过量的氢氧化钠溶液又产生气体F、溶液H和沉淀G,则F一定是氨气,即含有铵根。G中一定存在氢氧化铁。H中加入过量的CO2沉淀溶液J和沉淀I,则I应该是氢氧化铝,即H中含有偏铝酸钠,因此原溶液中含有铝离子。
(1)根据以上分析可知沉淀C的化学式为BaSO4,气体A的化学式为NO。
(2)向溶液H中通入过量CO2气体生成沉淀I的离子方程式为[Al(OH)4]-+CO2==Al(OH)3↓+HCO3-。
(3)次氯酸钾氧化氢氧化铁生成高铁酸钾的离子方程式为3ClO-+2Fe(OH)3+4OH-=2FeO42-+3Cl-+5H2O。
(4)根据以上分析可知无法确定的离子是C1-。由于溶液中的硫酸根离子能干扰氯离子的检验,则验证该离子是否存在的方法为取少量的B溶液于试管中,(滴加稀硝酸酸化),滴加AgNO3溶液,若有白色沉淀生成,证明含有C1-;若无白色沉淀生成,证明不含C1-。
考点:考查离子共存与检验的应该分析判断
本题难度:困难