0.30
A.金属乙能从硫酸铜溶液中置换出铜
B.甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀
C.在四种金属中,乙的还原性最强
D.甲、丁若形成原电池时,甲为正极
参考答案:B
本题解析:
试题分析:根据原电池中电子的流向判断金属的强弱,电压值越大,金属的活泼性越强,以此解答各题。甲-Cu连接时,电子从甲→Cu,所以甲的金属性大于铜;????乙-Cu连接时,电子从Cu→乙,所以乙的金属性小于铜;????丙-Cu连接时,电子从丙→Cu,所以丙的金属性大于铜;丁-Cu连接时,电子从丁→Cu,所以丁的金属性大于铜。A、金属乙的金属性小于铜,所以金属乙不能从硫酸铜溶液中置换出铜,故A错误;B、甲的金属性大于铜,乙的金属性小于铜,所以金属性是甲大于乙,甲、乙形成合金时,将该合金露置在空气中,甲
本题难度:简单
2、填空题 为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.
(1)高温下,让铁粉与水蒸气反应,见图.
试管中发生反应的化学方程式是______;其中______为氧化剂.
(2)
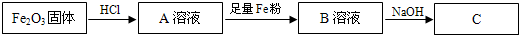
①往A、B溶液中分别滴入几滴KSCN溶液,溶液的颜色A______,B______.
②写出上述过程中有关反应的化学方程式:Fe2O3→A______;A→B______.
③B→C可看到的现象是______.
④将A的饱和溶液滴入沸水中并不断加热,可制得______胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为______效应.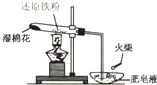
参考答案:(1)铁和水蒸气反应生成四氧化三铁和氢气,即3Fe+4H2O
本题解析:
本题难度:一般
3、填空题 (11分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基础化工原料。铬常见价态有+3、+6价。铬的主要自然资源是铬铁矿FeCr2O4(含有Al2O3、MgO、SiO2等杂质),实验室模拟工业以铬铁矿为原料生产红矾钠的主要流程如下:
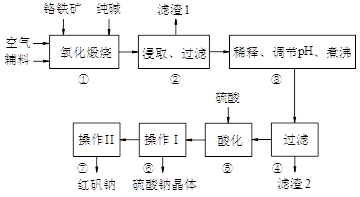
①中主要反应:4 FeCr2O4 + 8Na2CO3 + 7O2  ?8Na2CrO4 + 2Fe2O3 + 8CO2 ?8Na2CrO4 + 2Fe2O3 + 8CO2
①中副反应有多个如:Al2O3 + Na2CO3 2NaAlO2 + CO2↑等 2NaAlO2 + CO2↑等
请回答下列问题:
(1)FeCr2O4化学名为亚铬酸亚铁,写出它的氧化物形式________________。步骤“①”的反应器材质应选用__________(填“瓷质”、“铁质”或“石英质”)。请再写一个①中的副反应方程式????????????????????????
(2)“②”中滤渣1的成分是____ 和____,“③”中调pH值是_______ (填“调高”或“调低”),“④”中???滤渣2的成分是H2SiO3、Al(OH)3 。
(3)若步骤2的溶液中加入过量的硫酸生成沉淀,则相关的离子方程式是:__________________________。
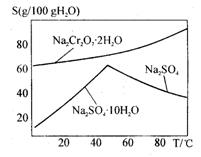
(4)上图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,则操作I是______,操作II 是______(填序号)。 是______(填序号)。
①蒸发浓缩,趁热过滤②降温结晶,过滤
参考答案:
 本题解析:略 本题解析:略
本题难度:一般
4、选择题 下列说法正确的是( )
A.工业上用C还原Al2O3产生Al
B.氯水能使红色花瓣褪色
C.常温下,硅与浓HNO3反应放出NO2
D.Fe(OH)2溶于NaOH溶液
参考答案:B
本题解析:
本题难度:一般
5、实验题 黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
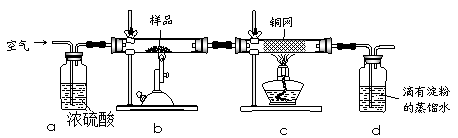 ? ?
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
(1)称量样品所用的仪器为????????(填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是?????????。
(2)装置a和c的作用分别是????和????(填标号)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是?????。
(4)通过计算可知,该黄铜矿的纯度为??????。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是?????(填序号)。
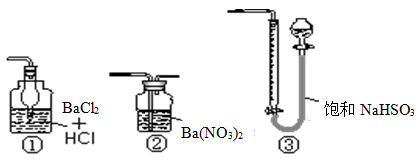
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有??????????。
参考答案:(1)电子天平,使原料充分反应、加快反应速率。
(2)
本题解析:(1)托盘天平的精确度为 0.1g,故只有电子天平才能称取1.150g样品;研细的目的是增大固体的表面积,使原料充分反应、加快反应速率;
(2)浓硫酸能除去空气中的水蒸气,且洗气瓶有利于观察空气流速;灼热铜网的目的是除去反应后多余的氧气;
(3)反应结束后,装置中还有SO2,所以仍需通入一段时间的空气,其目的是使反应生成的SO2全部进入d装置中,使结果精确;
(4)由c?V可知n(I2)=0.05mol/L×20.00×10-3L,由I2+SO2+2H2O=4H++2I-+SO42-可知
本题难度:一般
|