微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 用Pt电极电解浓度为17%的饱和硝酸银溶液,当金属银完全析出时,阳极上放出5.6 L气体(标准状况),电解后溶液的密度为1.038 g·cm-3。试计算:
(1)电解前原硝酸银溶液的总质量是多少?电解析出的银多少克?
(2)电解前硝酸银的溶解度是多少?
(3)电解后所得溶液的质量分数和物质的量浓度各为多少?
参考答案:(1)1000 g? 108 g??? (2)20.48 g
本题解析:(1)由4AgNO3+2H2O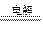 4Ag+4HNO3+O2↑,可知生成的5.6 L气体是O2,其物质的量为0.25 mol,质量为8 g,则析出银:0.25 mol×4×108 g·mol-1="108" g。
4Ag+4HNO3+O2↑,可知生成的5.6 L气体是O2,其物质的量为0.25 mol,质量为8 g,则析出银:0.25 mol×4×108 g·mol-1="108" g。
电解前硝酸银溶液的质量设为x。
 本题难度:简单
本题难度:简单
2、选择题 对于Fe-Cu-稀H2SO4组成的原电池中当有4mol电子通过导线时,则下列说法正确的是(??)
A.铁片溶解了56g
B.铜片上析出22.4L(标况下)气体
C.电解质溶液的pH逐渐减小
D.SO42-移向Fe电极
参考答案:D
本题解析:
正确答案:D
铁作负极,反应为Fe+2H+=H2↑+Fe2+ ,A、不正确,应溶解112gFe;B、不正确,应产生44.8LH2;C、不正确,pH应变大;D、正确,阴离子移向负极。
本题难度:简单
3、选择题 下列装置图或曲线图与对应的叙述相符的是
A.图1:负极反应是Fe-2e-=Fe2+
B.图2:酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去
C.图3:可表示乙酸溶液中通入氨气至过量过程中溶液导电性(I )的变化
D.图4:可表示在恒容密闭容器中反应“2SO2(g) +O2(g) 2SO3(g) ΔH<0”的平衡常数K正、K
2SO3(g) ΔH<0”的平衡常数K正、K
随温度的变化
参考答案:D
本题解析:
试题分析:A项:Zn比Fe活泼,Zn是负极,故错;B项:没有气泡出现说明没有SO2和CO2生成,KMnO4酸性溶液不会变色,故错;C项:开始反应生成强电解质乙酸铵,导电性应增强,故错。故选D。
点评:本题考查较为综合,涉及原电池、浓硫酸的性质、溶液导电性和平衡常数等知识,题目难度不大,注意把握影响平衡移动的因素以及平衡移动方向的判断。
本题难度:简单
4、填空题 (16分)
Ⅰ、工业上用含有Cr2O72-和CrO42-的废水回收铬。其工艺流程如下:
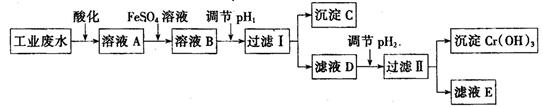
已知:①2 CrO42-(黄色)+2H+  Cr2O72-(橙色)+ H2O;
Cr2O72-(橙色)+ H2O;
②常温下,Ksp【Fe(OH)3】=1.0×10-38,Ksp【Cr(OH)3】=1.0×10-32;
③当离子浓度小于1.0×10-5mol·L-1时,认为沉淀完全。
(1)下列选项中能说明反应2 CrO42-(黄色)+2H+  Cr2O72-(橙色)+ H2O达平衡状态的是_______(填选项字母)。
Cr2O72-(橙色)+ H2O达平衡状态的是_______(填选项字母)。
A.Cr2O72-和CrO42-的浓度相同
B.2v(Cr2O72-)= v(CrO42-)
C.溶液的颜色不变
D.溶液的PH不变
(2)为防止FeSO4溶液变质,在保存时需加入的试剂为 (填试剂名称)
(3)过滤操作中需要用到的玻璃仪器有
(4)FeSO4溶液与溶液A发生反应的离子方程式为
(5)沉淀C的化学式为 ,pH2的范围为
Ⅱ、铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
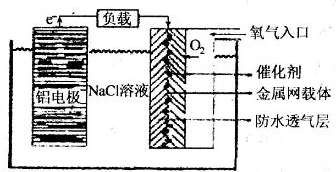
(6)该电池的总反应化学方程式为 ;
(7)某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为 。
参考答案:(1)cd(各1分,共2分)
(2)铁粉 硫酸 (各1
本题解析:
试题分析:
(1)2 CrO42-(黄色)+2H+  Cr2O72-(橙色)+ H2O达平衡状态时A.物质的平衡溶液与起始浓度与反应进行的程度有关,Cr2O72-和CrO42-的平衡浓度相同,不能判断是否达到平衡,故A错误。
Cr2O72-(橙色)+ H2O达平衡状态时A.物质的平衡溶液与起始浓度与反应进行的程度有关,Cr2O72-和CrO42-的平衡浓度相同,不能判断是否达到平衡,故A错误。
B. 2v(Cr2O72-)= v(CrO42-),没体现出正反应速率等于逆反应速率,不能判断是否平衡,故B错误。C.溶液的颜色不变,说明物质的浓度不再变化,说明反应达平衡状态。故C正确。D.溶液的pH不变,说明H+浓度不变,化学反应达平衡状态。故D正确。(2)为防止FeSO4溶液变质,在保存时需加入的试剂为铁粉防止氧化,加入硫酸防止亚铁离子水解变浑。(3)过滤操作中需要用到的玻璃仪器有烧杯 漏斗 玻璃棒 。(4)已知工业废水中含有和CrO42-在酸化过程中CrO42-转化为Cr2O72-,所以加入的FeSO4溶液与Cr2O72-溶液发生反应的离子方程式为r2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 。(5)已知常温下,Ksp【Fe(OH)3】=1.0×10-38<Ksp【Cr(OH)3】=1.0×10-32;调节pH1使Fe3+生成Fe(OH)3沉淀而析出,调节pH2目的是使Cr3+转化为Cr(OH)3而析出。由C(Cr3+)c3(OH-)=1×10-32,当Cr3+沉淀完全时
c3(OH-)=1×10-32/C(Cr3+)=1×10-32/1.0×10-5 =1×10-27
c(OH-)=1×10-9,pH=5,pH2的范围为pH2>5.
Ⅱ、(6)铝一空气电池的总反应化学方程式为4Al+3O2+6H2O=4Al(OH)3;(7)某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则生成NaOH的物质的量为0.15 mol。由原电池反应方程式与电解总方程式可得关系式:
Al----3e----3NaOH
27g 3mol
m(Al)×50% 0.15mol
解得: m(Al)=2.7g
考点:了解化学平衡建立的过程。理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能用相关理论解释其一般规律。 了解难溶电解质的沉淀溶解平衡。了解溶度积的含义及其表达式,能进行相关的计算。解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
点评:本题考查:化学平衡状态的判断依据:(1)速率判据:v正=v逆。(2)浓度判据:反应体系各物质的浓度(及与浓度相关的量如颜色、气体压强等)不再变化。熟练应用Ksp求算分离或除去某离子时的pH范围。电化学装置中的相关计算常采用电子守恒的方法。
本题难度:困难
5、选择题 有关铜-锌-稀硫酸构成的原电池中的一些说法正确的是
A.锌片为正极,且锌片逐渐溶解
B.铜片为负极,且铜片上有气泡
C.溶液中的H+移向铜极
D.该电池工作的过程中溶液的pH始终不变
参考答案:C
本题解析:
试题分析: 在此原电池中锌是负极,锌逐渐反应而溶解,铜是正极,溶液中的氢离子向铜电极移动,在铜极反应产生气体,电池工作的过程中氢离子浓度减小,故pH增大。故选C。
考点: 原电池的原理
本题难度:一般