微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.反应热是指反应过程中放出的热量
B.1/2 molH2SO4和1/2 molBa(OH)2完全中和所放出的热量为中和热
C.同温同压下,H2(g)+Cl2(g)==2HCl(g)在光照和点燃条件下的ΔH不同
D.物质发生化学变化都伴随着能量变化
2、选择题 一些盐的结晶水合物,在温度不太高时就有熔化现象,即溶于自身的洁净水中,又同时吸收热量。他们在塑料袋中经日晒就熔化,又在日落后缓慢凝结而释放热量。故可用于调节室内温度,或用作夏日防暑的枕垫或坐垫,这些物质可称之为热材料。现有几种盐的结晶水合物有关数据如下:
?
| ① Na2S2O3·5H2O
| ②CaCl2·6H2O
| ③ Na2SO4·10H2O
| ④ Na2HPO4·10H2O
|
熔点/℃
| 40~50
| 29.92
| 32.38
| 35.1
|
熔化热/kJ· mol-1
| 49.7
| 37.3
| 77
| 100.1
根据上述数据和实用性考虑,实际运用时常采用的物质应该是
A.①??????? B.②??????? C.③?????? D.④
3、简答题 红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
据图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式______;
(2)PCl5分解生成PCl3和Cl2的热化学方程式______;
上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol?PCl5,反应达到平衡时还剩余0.6mol?PCl5,其分解率α1等于______;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2______α1(填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因是______;
(4)P和Cl2分两步反应生成1mol?PCl5的△H3=______;P和Cl2一步反应生成1mol?PCl5的△H4______△H3(填“大于”、“小于”或“等于”),原因是______.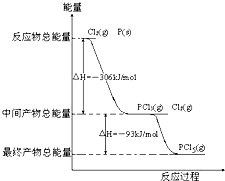
4、选择题 下列有关热化学方程式的叙述正确的是
A.已知2H2(g)+O2(g) ==2H2O(l);△H=-571.6kJ·mol-1,则H2的燃烧热为285.8kJ·mol-1
B.已知4P(红磷,s)="=" P4(白磷,s);△H>0,则白磷比红磷稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq) ="=" CH3COONa(aq) + H2O(l) △H =-57.4kJ·mol-1
D.已知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)="2CO(g)" △H2,则△H1>△H2
5、实验题 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反
应速率的因素。
甲同学研究的实验报告如下表:
实?验?步?骤
| 现?象
| 结?论
| ①分别取等体积的2 mol/L硫酸于试管中;
②分别投入大小、形状相同的Cu、Fe、Mg。
| 反应快慢:
Mg>Fe>Cu
| 反应物的性质越活泼,反应速率越快。
(1)该同学的实验目的是________________________________;
要得出正确的实验结论,还需控制的实验条件是________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品是______;应该测定的实验数据是____________________________。
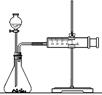
(3)在使用铁与稀硫酸反应制氢气时,实验室里选择粗铁比纯铁效果更好,原因是:?????????????????????????????????????????????????????????????????????。
|
|