微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (14分)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:

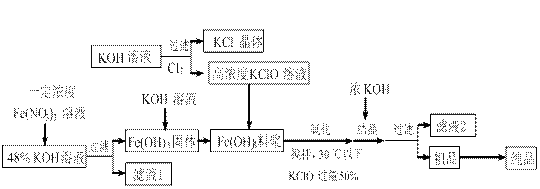
(1)在农业生产中,滤液1可用作? ????????▲?????????。
????????▲?????????。
(2)上述氧化过程中,发生反应的离子方程式是:??????????▲????????,控制反应温度30℃以下的原因是:????????????▲???????????????。
(3)结晶过程中加入浓KOH溶液的作用是:???????????▲???????????。
(4)某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KCl O3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为??????▲?????。
O3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为??????▲?????。
(5)实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如图1、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在????▲????附近、反应时间应控制在??????▲??????。

2、填空题 (9分)早在春秋战国时期,我国就开始生产和使用铁器。
(1)写出用CO和赤铁矿(主要成分Fe2O3)为原料炼铁的化学方程式
?????????????????????????????????????????,盛水的铁锅与水面接触的一圈最易生锈。钢铁生锈的条件是???????????????????,利用新技术能将不锈钢加工成柔软的金属丝,这是利用了不锈钢的??????????(填字母)。
A.耐腐蚀性
B.延展性
C.导热性
D.导电性
(2)设计从废水中回收硫酸亚铁固体和铜的实验方案如下:

金属X是????????,
写出上述实验方案中有关反应的化学方程式
①????????????????????????????????②???????????????????????????????????。
3、选择题 某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中各阳离子的浓度相同(不?考虑溶液中离子的变化),且SO42-的物质的量浓度为6mol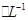 ,则此溶液最多能溶解铁粉的质量为
,则此溶液最多能溶解铁粉的质量为
A.5.6g
B.11.2 g
C.22.4g
D.33.6g
4、选择题 将锌、铁、铜粉末按一定比例混合投入到一定量的硝酸中,微热,充分反应后过滤,弃去滤渣,滤液中金属阳离子情况不可能是
A.只含Cu2+、Fe2+、Zn2+
B.只含Zn2+
C.只含Fe2+、Zn2+
D.只含Cu2+、Fe3+、Zn2+
5、填空题 (8分)微生物对人类有着各种各样的用途,现在生物工程学家利用微生物从矿石中提取金属。铜是一种很有价值的金属,可以从铜矿中提取。微生物法是采用某些细菌能用空气中的氧气氧化硫化铜矿石,把不溶性的硫化铜转化成可溶的硫酸铜。利用细菌提取铜的生产过程:在已有细菌存在的岩石、矿石堆中,喷洒酸水以促进细菌生长;在它们的生长过程中,氧化而成的硫酸铜形成低浓度的溶液流到矿石堆的底部,再从这种溶液中提取金属铜。水循环使用,再回到矿石堆中。在美国,10%的铜是用这种方法生产的。
试回答下列问题:
(1)细菌把硫化铜氧化为硫酸铜的过程中起了什么作用:???????????????????
(2)从硫酸铜溶液中提取铜,简便而经济的方法是???????????????????????;相应的化学方程式为:???????????????????????????????????????????
(3)普通生产铜的方法是在空气中燃烧硫化铜(产物中有一种气态氧化物)。试比较两种方法的优缺点。?????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????