微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某化学兴趣小组用下图装置电解CuSO4溶液,测定铜的相对分子质量。
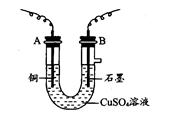
(1)若实验中测定在标准状况下放出的氧气的体积VL,A连接直流电源的__________ (填“正极”或“负极”)。
(2)电解开始一段时间后,在U形管中可观察到的现象-____________________________。
电解的离子方程式为 。
(3)实验中还需测定的数据是_______________(填写序号)。
①A极的质量增重m g ②B极的质量增重m g
(4)下列实验操作中必要的是____________(填字母)。
A.称量电解前电极的质量
B.电解后,电极在烘干称重前,必须用蒸馏水冲洗
C.刮下电解过程中电极上析出的铜,并清洗、称重
D.电极在烘干称重的操作中必须按“烘干—称重一再烘干一再称重”进行
E.在有空气存在的情况下,烘干电极必须采用低温烘干的方法
(5)铜的相对原子质量为:_______________________(用含有m、V的计算式表示)。
(6)如果用碱性(KOH为电解质)甲醇燃料电池作为电源进行实验,放电时负极的电极反应式为 。
参考答案:(1)负 (2)A极变粗,B极有气泡产生,溶液颜色
本题解析:
试题分析:(1)测得O2的体积为VL,A极为负极,
(2)现象为A极变粗,B极有气泡产生,溶液颜色变浅,电极反应式为2Cu2++2H2O 2Cu+O2↑+4H+(4)电极上析出的Cu的质量不需要挂下,只需要称出A极质量的增加量,故不需要C项的操作。
2Cu+O2↑+4H+(4)电极上析出的Cu的质量不需要挂下,只需要称出A极质量的增加量,故不需要C项的操作。
(5) 设铜的摩尔质量为Mmol/g 2Cu~O2
2M 1
m V/22.4
解得M=11.2m/V
考点:考查电解原理、计算等相关知识。
本题难度:一般
2、选择题 近年来,加“碘”食盐较多使用了碘酸钾,KIO3在工业上可用电解法制取,以石墨和铁为电极,以KI溶液为电解液在一定条件下电解,反应式为:KI+H2O→KIO3+H2↑.下列有关说法中,正确的是( )
A.电解时,石墨做阳极,铁作阴极
B.电解时,在阳极上产生氢气
C.电解后得到KIO3产品的步骤有:过滤→浓缩→结晶→灼烧
D.电解中,每转移0.6mol电子,理论上可得到0.1mol无水KIO3晶体
参考答案:A、反应式为:KI+H2O→KIO3+H2↑,阳极是惰性电极
本题解析:
本题难度:一般
3、选择题 加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。下列说法正确的是
 [???? ]
[???? ]
A.a电极是阴极
B.a极区的KI最终转变为KIO3
C.阳极电极反应:4OH--4e-==2H2O+O2↑
D.电解过程中OH-从a极区通过离子交换膜c进入b极区
参考答案:B
本题解析:
本题难度:一般
4、选择题 最近有研究人员发现了一种处理高浓度乙醛废水的新方法—?隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。下列说法正确的是???
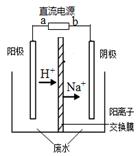 ????
????
A.若以CH4—空气燃料电池为直流电源,燃料电池的b极应通入空气
B.电解过程中,阴极区Na2SO4的物质的量增大
C.阳极反应CH3CHO -2e- + 2H+="=" CH3COOH + H2O
D.电解过程中,两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2
参考答案:D
本题解析:
试题分析:A.若以CH4—空气燃料电池为直流电源,根据同种电荷相互排斥,异种电荷相互吸引的原则,由于H+、Na+由阳极区向阴极去移动。说明a为正极,应通入空气;b是负极,通入甲烷气体。错误。B. 电解过程中,Na2SO4电离产生的离子在两个电极都不发生反应,故其物质的量不变。错误。C. 阳极反应应该为CH3CHO -2e- + H2O ="=" CH3COOH +2H+。错误。D. 电解过程中,两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2,阴极产生H2。正确。
本题难度:一般
5、填空题 熔融盐燃料电池具有较高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO )为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO
)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO -52e-===34CO2+10H2O。
-52e-===34CO2+10H2O。
试回答下列问题:
(1)该燃料电池的化学反应方程式为______________________________________________;
(2)正极电极反应式为____________________________________________。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是________,它来自____________。
(4)某学生想用该燃料电池和如图所示装置来电解饱和食盐水:
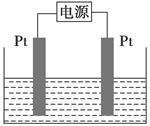
①写出反应的离子方程式_______________________________________。
②将湿润的淀粉KI试纸放在该装置附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸。该反应的化学方程式为_______________________________________________________________。
③若电解后得到200 mL 3.25 mol·L-1 NaOH溶液,则消耗C4H10的体积在标准状况下为________mL。
参考答案:(1)2C4H10+13O2===8CO2+10H2O
本题解析:
试题分析:(1)该燃料电池的反应实质是丁烷与氧气反应生成二氧化碳、水,所以总反应的化学方程式为2C4H10+13O2===8CO2+10H2O
(2)用总反应方程式减去负极反应方程式可得正极反应方程式为13O2+26CO2+52e-===26CO
(3)该反应的中有水生成,所以在空气中应充入二氧化碳,以保证碳酸钾电解质的稳定性;二氧化碳来自于电池的负极;
(4)①电解饱和食盐水得到氯气、氢气、氢氧化钠,反应的离子方程式为2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
②氯气将生成的I2氧化,得到两种酸,反应的Cl2和I2的物质的量之比为5∶1,说明1个Cl原子得电子的数目是1个I原子失去电子数目的1/5,所以Cl的化合价由0价降为-1价,则I的化合价由0价升高为+5价,结合溶液中的水判断该两种酸是HCl和H HIO3,化学方程式为5Cl2+I2+6H2O===10HCl+2HIO3
③电解后得到200 mL 3.25 mol·L-1 NaOH溶液,氢氧化钠的物质的量 是0.65mol,转移电子的物质的量是0.65mol,根据2C4H10+26CO -52e-===34CO2+10H2O,得需要丁烷的物质的量是0.025mol,标准状况下的体积是0.025mol×22.4L/mol=0.56L=560mL。
-52e-===34CO2+10H2O,得需要丁烷的物质的量是0.025mol,标准状况下的体积是0.025mol×22.4L/mol=0.56L=560mL。
考点:考查电化学反应原理的应用与计算
本题难度:困难