微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列判断正确的是 [???? ]
A.以镁和铝为电极,氢氧化钠溶液为电解质溶液,镁做负极
B.以铜和铝为电极,浓硝酸为电解质溶液,铜做负极
C.Cu + 2H2O = Cu(OH)2 + H2反应,在任何条件下都不能发生
D.电镀时,电解质的浓度一定保持不变
参考答案:B
本题解析:
本题难度:简单
2、填空题 (11分)以食盐为原料进行生产并综合利用的某些过程如下图所示。
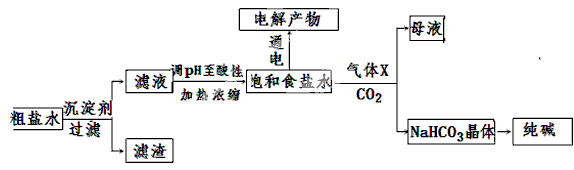
(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填字母) 。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是 。
(3)电解饱和食盐水可得到H2和另外两种产物,这两种物质相互反应的离子方程式为 ,欲从饱和食盐水中获得食盐晶体,可采用的实验方法是 。
(4)气体X可增大饱和食盐水吸收CO2的量,有利于NaHCO3晶体的生成和析出,X的化学式是 。
(5)下列有关NaHCO3和纯碱的说法正确的是 (填字母)
A.NaHCO3属于盐类,纯碱属于碱
B.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,产生气泡的速率相同
C.常温下在水中的溶解度,NaHCO3大于纯碱
D.除去NaHCO3溶液中的纯碱,应往溶液中通入足量的CO2
参考答案:(1)cab或者cba或者bca (2)CO32-
本题解析:
试题分析:(1)总体思路是先沉淀再过滤,沉淀时要先加BaCl2溶液,再加Na2CO3溶液,因为碳酸钠能把过量的氯化钡沉淀出来,氢氧化钠可放在它们前面,也可放在它们后面或中间,都完全沉淀完后再过滤;
(2)加入适量盐酸pH调至酸性除去的离子是CO32-和OH-,故答案为:CO32-和OH-;
(3)电解饱和食盐水制取氯气的反应为2NaCl+2H2O 2NaOH+H2↑+Cl2↑,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;从饱和食盐水中获得食盐晶体的方法是利用氯化钠溶解度随温度变化不大分析,用蒸发结晶方法得到;
2NaOH+H2↑+Cl2↑,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;从饱和食盐水中获得食盐晶体的方法是利用氯化钠溶解度随温度变化不大分析,用蒸发结晶方法得到;
(4)向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱,气体X为NH3,可增大饱和食盐水吸收CO2的量,有利于NaHCO3晶体的生成和析出;
(5)加热碳酸氢钠晶体可制得纯碱,反应的化学方程式为:2NaHCO3 Na2CO3+CO2↑+H2O;NaHCO3不稳定,溶解度比Na2CO3小,与盐酸反应较Na2CO3剧烈,可与NaOH反应生成Na2CO3,Na2CO3和NaHCO3都为强碱弱酸盐,溶液水解呈碱性,但Na2CO3水解程度较大,溶液碱性较强;A.NaHCO3属于盐类,纯碱是碳酸钠属于盐,故A错误;B.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,产生气泡的速率碳酸氢钠放出气泡比碳酸钠放出气泡快,故B错误;C.常温下在水中的溶解度,NaHCO3小于纯碱,故C错误;D.除去NaHCO3溶液中的纯碱,应往溶液中通入足量的CO2,二氧化碳和碳酸钠和水反应生成碳酸氢钠,可以除去碳酸钠;故选D。
Na2CO3+CO2↑+H2O;NaHCO3不稳定,溶解度比Na2CO3小,与盐酸反应较Na2CO3剧烈,可与NaOH反应生成Na2CO3,Na2CO3和NaHCO3都为强碱弱酸盐,溶液水解呈碱性,但Na2CO3水解程度较大,溶液碱性较强;A.NaHCO3属于盐类,纯碱是碳酸钠属于盐,故A错误;B.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,产生气泡的速率碳酸氢钠放出气泡比碳酸钠放出气泡快,故B错误;C.常温下在水中的溶解度,NaHCO3小于纯碱,故C错误;D.除去NaHCO3溶液中的纯碱,应往溶液中通入足量的CO2,二氧化碳和碳酸钠和水反应生成碳酸氢钠,可以除去碳酸钠;故选D。
考点:考查海水资源的利用,实验过程分析判断,反应原理的理解应用
本题难度:一般
3、填空题 已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):
①A+B 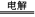 M+D+E;②E+M=A+F+B
M+D+E;②E+M=A+F+B

请回答:
(1)若A是一种钠盐,该反应是化学工业上制单质E和化合物M的重要方法。该化学工业称为 (填字母编号:a.硫酸工 业 b.氯碱工业 c.合成氨工业d.侯氏制碱工业),写出上述反应②的离子方程式为__________ 。
(2)若A是一种含氧酸盐,该反应中电极上会析出红色固体。则其电解反应方程式是: 。上述两种不同反应中的产物E((1)题)和产物F((2)题)有一种共同的用途是__ ____, 二者反应的离子方程式为______________ __。
参考答案:(共9分,第1空1分,其余各2分)(1)氯碱工业, Cl2+
本题解析:
试题分析:(1)若A是一种钠盐,该反应是化学工业上制单质E和化合物M的重要方法,则该化学工业称为氯碱工业,所以A是氯化钠,B是水,M是氢氧化钠。则根据反应②可知,E是氯气,所以D是氢气,F是次氯酸钠,因此反应②的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
(2)若A是一种含氧酸盐,该反应中电极上会析出红色固体,则A应该是硫酸铜,B是水,E是铜,M是硫酸,F是二氧化硫,D是氧气,所以电解反应方程式是2CuSO4+2H2O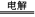 2Cu+O2↑+H2SO4。氯气和二氧化硫都具有漂泊性。又因为氯气具有氧化性,二氧化硫具有还原性,所以二者混合反应的离子方程式是Cl2+SO2+2H2O=4H++2Cl-+SO42-。
2Cu+O2↑+H2SO4。氯气和二氧化硫都具有漂泊性。又因为氯气具有氧化性,二氧化硫具有还原性,所以二者混合反应的离子方程式是Cl2+SO2+2H2O=4H++2Cl-+SO42-。
考点:考查电解产物的有关判断、方程式的书写
点评:该题是中等难度的试题,试题注重基础,侧重考查学生对电解原理应用的了解掌握程度,以及灵活运用基础知识解决实际问题的能力。该题学生需要明确的是化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
4、填空题 (每空2分,共14分)电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
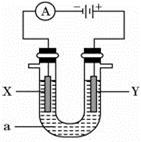
(1)若X、Y都是惰性电极,a是饱和KCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则①Y电极上的电极反应式为____________________,该电极产生的现象是 。
②该反应的总反应化学方程式是: ______________________________________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是__________,电极反应式是____________________。
(3)若用惰性电极电解500 mL CuSO4溶液,溶液中 Cu2+ 完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极质量增加1.6 g。
①要使电解后溶液恢复到电解前的状态,需加入一定量的________(填加入物质的化学式)。(假设电解前后溶液的体积不变)
②溶液的pH= 。
参考答案:(1)①2Cl——2e-=Cl2 ↑
本题解析:
试题分析:(1)①和电源的正极相连的电极Y极是阳极,该电极上Cl-离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,现象为产生淡黄绿色气泡②阳极上是Cl-离子失电子,阴极上是H+离子得电子,电解总反应离子方程式为:2KCl+2H2O 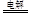 2KOH+Cl2 ↑+H2↑;
2KOH+Cl2 ↑+H2↑;
(2)①电解方法精炼粗铜,电解池的阴极材料是纯铜;电极反应为Cu2++2e-=Cu;
(3)惰性电极电极硫酸铜溶液,从溶液中析出的物质有铜和氧气,所以需加入一定量CuO或CuCO3,
②该反应总的电解方程式为2CuSO4 +2H2O 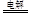 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
128 2
1.6 x 解得x=0.025mol
[H+]=0.05/0.5=0.1mol/L,则溶液的PH=1.
考点:考查电解原理的应用。
本题难度:一般
5、选择题 下列有关水的电解实验的说法中不正确的是[???? ]
A.为提高水的电解速率,可以在水中加入少量的氯化钠
B.若在水中加入少量的硫酸钠,电解结束后溶液的pH将会保持不变
C.电解过程中,阴极区附近的溶液的pH会升高
D.当电解产生氧气1.12 L(标准状况)时,转移的电子总数为0.2mol
参考答案:A
本题解析:
本题难度:一般