微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 砷是第四周期ⅤA族元素,根据其在周期表中的位置排列,砷不可能具有的性质是
A.砷的单质在通常情况下是固体
B.As2O5的水化物是一种强酸
C.AsH3比PH3稳定
D.砷的常见化合价有-3、+3、+5
参考答案:B
本题解析:根据氮族元素及其化合物的性质及同主族元素的性质递变规律来分析解答.氮族元素从上到下,其单质由气体→固态变化,磷单质呈固态,则砷的单质在通常情况下也应是固体;氮族元素从上到下,最高价氧化物的水化物的酸性逐渐减弱,HNO3为强酸;H3PO4为中强酸,则H3AsO;应为弱酸;氮族元素从上到下,气态氢化物的稳定性逐渐减弱,则PH3比AsH3稳定氮族元素的常见化合价为-3,+3,+5,则砷的常见化合价也应为-3,+3,+5
本题难度:困难
2、推断题 【二选一—选修3:物质结构与性质】
已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素。其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍。D、E为同主族元素,且E的原子序数为D的2倍。F元素在地壳中含量位于金属元素的第二位。试回答下列问题:
(1)F元素价层电子排布式为?____________________。
(2)关于B2A2的下列说法中正确的是?________________。
A.B2A2中的所有原子都满足8电子结构?????????
B.每个B2A2分子中σ键和π键数目比为1:1
C.B2A2是由极性键和非极性键形成的非极性分子????
D.B2A2分子中的B-A键属于s—pσ键
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的空间构型是?________________。
(4)C元素原子的第一电离能比B、D两元素原子的第一电离能高的主要原因____________
(5)A与D可以形成原子个数比分别为2:1,1:1的两种化合物X和Y,其中?Y含有_____________键(填“极性键”“非极性键”),A与C组成的两种化合物M和N所含的电子数分别与X、Y相?等,则M的电子式为_____________?,N的结构式为______________。
(6)E的氢化物的价层电子对互斥理论模型为?_______,E?原子的杂化方式为?_________杂化。
(7)F单质的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。面心立方晶胞和体心立方晶胞的棱边长分别为acm、bcm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为____________,F原子配位数之比为_____________。

参考答案:(1)3d64s2;?
(2)CD
(3)直线型
本题解析:
本题难度:一般
3、选择题 下列说法正确的是
A.金属元素不能得电子,不显负价,故金属元素不能形成阴离子
B.P、S、Cl元素最高正价依次升高
C.B、C、N、O、F原子半径依次增大
D.Li、Na、K、Rb的氧化物对应水化物的碱性依次减弱
参考答案:B
本题解析:选B。A选项中金属元素无负价,但可以形成阴离子,如  、
、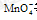 等,同周期元素从左向右,原子半径逐渐减小,元素的最高正价逐渐升高,从Li到Rb,金属性依次增强,所以对应的碱的碱性依次增强。
等,同周期元素从左向右,原子半径逐渐减小,元素的最高正价逐渐升高,从Li到Rb,金属性依次增强,所以对应的碱的碱性依次增强。
本题难度:困难
4、选择题 下列有关试剂的保存方法,错误的是
A.金属钠保存在煤油中
B.存放FeSO4溶液时加入少量铁粉
C.NaOH溶液保存在带胶塞的玻璃试剂瓶中
D.新制的氯水保存在无色广口瓶中
参考答案:D
本题解析:
试题分析:新制的氯水保存在棕色细口瓶中,所以D错误。金属钠保存在煤油中,防止和空气、水等反应,A正确;B.存放FeSO4溶液时加入少量铁粉,防止Fe2+氧化,正确;C.NaOH溶液保存在带胶塞的玻璃试剂瓶中,可防止瓶塞粘连,正确;
本题难度:一般
5、选择题 下列两种物质发生反应:①Na和O2②AlCl3与氨水?③水玻璃与CO2?④Fe与Cl2?⑤Cu和HNO3,因反应物用量或反应条件的不同而生成不同产物的是
A.①②③④⑤
B.①②③⑤
C.①②⑤
D.①③⑤
参考答案:D
本题解析:
试题分析:①Na和O2,常温缓慢氧化和点燃条件下分别得到氧化钠和过氧化钠,产物不同;②AlCl3与氨水只能生成氢氧化铝沉淀,产物相同;③水玻璃与CO2,通入CO2的量不同可得到碳酸钠或碳酸氢钠,产物不同;④Fe与Cl2 只能生成FeCl3,产物相同;⑤Cu和HNO3,稀硝酸和浓硝酸分别生成NO和NO2,产物不同。综合判断选①③⑤。
本题难度:一般