微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________________,烧杯间满碎塑料泡沫的作用是______________________________________________。
(2)大烧杯上如不盖硬纸板,则求得的中和热数值_______(填“偏大”、“偏小”、“无影响”)
(3)实验中改用60 mL 0.50 mol/L的来源:91考试 网盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,溶液温度升高度数________(填“相等”或“不相等”)。所求中和热的数值会________(填“相等”或“不相等”),理由是 。
参考答案:(1)环形玻璃搅拌棒;保温、隔热,减少实验过程中的热最损失;
本题解析:
试题分析:(1)中和热的测定需要仪器:两个口径不同的烧杯、温度计、环形玻璃搅拌棒、硬纸板、碎塑料泡沫或者碎纸片,因此图中缺少的玻璃用品是环形玻璃搅拌棒;本实验要减少热量的损失,因此两个烧杯之间填充碎塑料泡沫或碎纸片;(2)如果不盖硬纸板,会造成热量的损失,△H=cm△t/n(H2O),△t偏小,因此所得中和热数值偏小;(3)两个实验产生水的物质的量不同,放出热量不同,所测温度升高的度数不相等,但所求中和热的数值不变,因为中和热指酸与碱反应生成lmolH2O所放出的热量,与酸碱的用量无关。
考点:考查中和热测定实验。
本题难度:困难
2、填空题 已知:C(s) + O2(g)  CO2(g) ΔH=-437.3 kJ?mol-1
CO2(g) ΔH=-437.3 kJ?mol-1
H2(g) +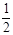 O2(g)
O2(g)  H2O(g) ΔH=-285.8 kJ?mol-1
H2O(g) ΔH=-285.8 kJ?mol-1
CO(g) +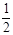 O2(g)
O2(g)  CO2(g) ΔH=-283.0 kJ?mol-1
CO2(g) ΔH=-283.0 kJ?mol-1
则固态碳与水蒸汽反应生成一氧化碳和氢气的热化学方程式是
参考答案:) C(s)+H2O(g)==CO(g)+H2(
本题解析:
试题分析:固态碳与水蒸汽反应生成一氧化碳和氢气的的热化学方程式是C(s)+H2O(g)==CO(g)+H2(g) ,DH ="X" kJ/mol,它可以由C(s) + O2(g)  CO2(g)减去H2(g) +
CO2(g)减去H2(g) +  O2(g)
O2(g)  H2O(g) 再减去CO(g) +
H2O(g) 再减去CO(g) +  O2(g)
O2(g)  CO2(g)得到,所以DH =-437.3-(-285.8-283.0)=131.5kJ/mol,所以固态碳与水蒸汽反应生成一氧化碳和氢气的热化学方程式是C(s)+H2O(g)==CO(g)+H2(g) DH =+131.5kJ/mol。
CO2(g)得到,所以DH =-437.3-(-285.8-283.0)=131.5kJ/mol,所以固态碳与水蒸汽反应生成一氧化碳和氢气的热化学方程式是C(s)+H2O(g)==CO(g)+H2(g) DH =+131.5kJ/mol。
考点:热化学方程式的书写
点评:本题考查了热化学方程式的书写,注意要标明各物质的状态。本题不难。
本题难度:一般
3、填空题 (6分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 KJ。
参考答案:(6分)(1)N2H4(l)+2H2O2(l)=N2(g)+
本题解析:
试题分析:(1)0.4mol液态肼放出256.652KJ的热量,则1mol液态肼放出256.652kJ/0.4=641.63KJ的热量,所以N2H4(l)+2H2O2(l)=N2(g)+4H2O (g); △H="-641.63" KJ/mol;(2)16g液态肼的物质的量为0.5mol,生成液态水时放出的热量为641.63 KJ/mol×0.5mol+44kJ/mol×2mol=408.815kJ。
考点:热化学方程式及反应热的计算
本题难度:一般
4、选择题 下列分子或离子中,含有孤电子对最多的是( )
A.H2S
B.NH3
C.H3O+
D.NH4+
参考答案:A.硫化氢分子中孤电子对个数=
本题解析:
本题难度:一般
5、判断题 将硼酸、发烟硫酸、萤石粉共热得到无色气体A,A为平面构型分子,密度约为空气的2.3倍,A用乙醚吸收后得到液态物质B。液态乙酸中存在微弱的自偶电离,离子电导率为139μS/cm,将B加入乙酸中形成均一透明的无色溶液,发现乙酸的离子电导率显著增强,达到1300-5800μS/cm,B与乙酸的混合溶液是具有良好应用前景的非水型电解质,与传统的水溶液电解质体系相比有独特的优势,扩大了电化学反应研究的物质范围和电位研究区间。试回答下列问题:
⑴ 写出A、B的结构简式? A _____________,B______________
⑵ 写出生成A的化学反应方程式____________________________________
⑶ 用方程式表示乙酸的自偶电离过程,并分析乙酸中加入B后,电导率显著提高的原因
⑷ 红外光谱显示,纯乙酸中存在两种羧羟基吸收峰,分析这两种峰产生的原因
⑸ 为什么说非水型电解质可以扩大电化学反应研究的物质范围和电位区间?
参考答案:⑴ A:BF3,??? B:(CH3CH2)2O·BF3??
本题解析:⑴ A的摩尔质量约为29×2.3=67(g/mol),且为平面分子,结合反应物中存的原子种类,可以推测A为BF3,经验证正确。B为BF3与O(CH2CH3)2的简单加合产物,即F3B←O(CH2CH3)2。
⑵ A的生成过程可以看成是两个反应的结果,即CaF2与浓H2SO4反应生成HF,然后生的HF迅速与H3BO3发生化学反应生成BF3和水。当然也可以把两个方程式写成一个反应方程式:3H2SO4 + 2H3BO3 + 3CaF2 ="==" 2BF3 + 3CaSO4 + 6H2O。
⑶ 自偶
本题难度:一般