? 6.7
???
请回答下列问题:
(1)第①步操作前需将金属混合物进行粉碎,其目的是?????????????????????????????;
(2)某学生认为用H2O2代替浓HNO3更好,理由是???????????????????????????????????;
请写出Cu溶于H2O2与稀硫酸混合溶液的离子方程式是?????????????????????????????????。
(3)第②步中应将溶液pH调至?????????????????。
(4)由滤渣2制取Al2( SO4)3.18H2O,探究小组设计了两种方案:
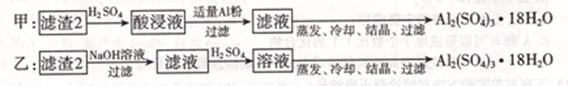
你认为????????种方案为最佳方案,理由是??????????????????、?????????????????。
(5)为了测定硫酸铜晶体的纯度,某同学准确称取4.0g样品溶于水配成l00mL溶液,取l0m溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.l000mol·L-1Na2S2O3标准溶液滴定至终点,共消耗14. 00mL Na2S2O3标准溶液。上述过程中反应的离子方程式如下:
2Cu2+ +4I-=2CuI(白色)↓+I2??? 2S2O +I2= 2I-+S4O +I2= 2I-+S4O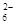
①样品中硫酸铜晶体的质量分数为____????????????。
②另一位同学提出通过测定样品中硫酸根离子的量也可求得硫酸铜晶体的纯度,其他同学认为此方案不可行,理由是?????????????????????????。
参考答案:
(1)增大接触表面积,加快反应速率;
(2)不
本题解析:
试题分析:本工业流程中原料主要含Cu、Al及少量Fc、Au、Pt等金属的混合物,在为得到目标产物,需除去有关杂质,经系列变化才能得到。(1)将金属混合物进行粉碎,目的是增大接触表面积,加快反应速率;(2)H2O2是绿色氧化剂,不产生污染物。该流程中硝酸的作用是氧化剂,氧化铜的同时生成了污染气体氮的氧化物,故其优点是不产生污染气体;(3)要使Al3+、Fe3+等杂质离子沉淀出来从而除去,故pH控制在5.2——5.4间;(4)乙方案反应得到的溶液中含有Al2( SO4)3和Na2SO4,所以结晶出的晶体不纯,同时反应消耗的酸碱的量较少,原子利用率高;
(5)n(Cu2+)="2" n( I2)= n(S2O )=1.4×l0-3mol )=1.4×l0-3mol
硫酸铜晶体的质量分数为1.4×l0-3×250/4×10=0.875
杂质主要是Na2SO4,含有硫酸根离子,不能准确得到硫酸铜晶体的量。
本题难度:困难
2、实验题 (9分)I.某氯化钠固体样品中含有少量的硫酸钠和碳酸钠杂质,按下列流程进行净化,步骤如下(用于沉淀的试剂稍过量):
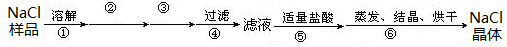
步骤②③依次加入的试剂是?????????????????。
II.海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取单质碘(I2)的流程如下:
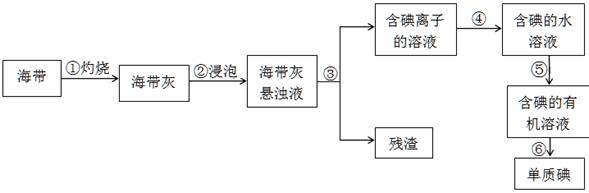
(1)①~⑥中发生化学变化的是??????????。
(2)步骤⑤所使用的玻璃仪器名称是???????,选择的有机试剂可以是???????。
A.酒精??????? B.四氯化碳???????? C.醋酸???????? D.苯
(3)步骤⑥从含碘的有机溶液中提取碘并回收有机溶剂,还需要经过蒸馏(如下图所示)。冷水的流向为??????到??????。(填A、B)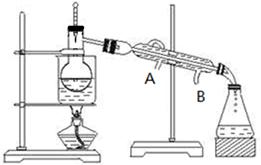
参考答案:I.? BaCl2溶液(1分) Na2CO3溶液(1分)??
本题解析:I.考查物质的分离和提纯。Ca2+用碳酸钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但用于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,所以步骤②③依次加入的试剂是氯化钡溶液和碳酸钠溶液。
II.(1)海带灼烧会发生化学变化,碘离子生成单质碘的反应也化学反应,选项①④是化学变化,其余都是物理变化,答案选①④。
(2)步骤⑤是萃取,所以需要的玻璃仪器是分液漏斗、烧杯;选用的萃取剂的原则:?①和原溶液中的溶剂互不相溶;?②对溶质的溶解度要远大于原溶剂,酒精和醋酸与水都是互溶的,不能作为萃取剂,所以答案选BD。
(3)蒸馏时,气体的流向与冷却水的流向是相反的,所以冷却水的流向是B进A出。
本题难度:一般
3、选择题 下列说法正确的是( )
A.实验室里需要480 mL 2.0 mol/L的氢氧化钠溶液,配制溶液时先称量氢氧化钠固体38.4 g,然后再按照溶解、冷却、洗涤、定容、摇匀的步骤进行操作
B.用标准盐酸滴定NaOH溶液测其浓度时,酸式滴定管用蒸馏水洗涤后,没用标准盐酸润洗,直接装标准盐酸滴定,所测的碱液浓度偏低
C.蒸发硫酸铜溶液时蒸发皿放在石棉网上加热,并用坩埚钳夹取蒸发皿
D.向氢氧化铁胶体中逐滴加入稀硫酸,先出现红褐色沉淀,继续滴加稀硫酸,沉淀溶解得到黄色溶液
参考答案:D
本题解析:实验室没有480 mL的容量瓶,因此应选用500 mL容量瓶进行配制,计算溶质质量应以500 mL进行计算,A项错误;酸式滴定管未用标准盐酸润洗,造成标准盐酸的浓度降低,导致测定时消耗盐酸的体积增大,计算结果偏高,B项错误;蒸发皿耐热,加热时不需要垫石棉网,C项错误;氢氧化铁胶粒带电,加入电解质发生凝聚,过量稀硫酸与Fe(OH)3反应生成Fe2(SO4)3而使聚沉的Fe(OH)3溶解,D项正确。
本题难度:简单
4、选择题 以下是一些常用的危险品标志,存放氢氧化钠的容器应贴的标签是(?????)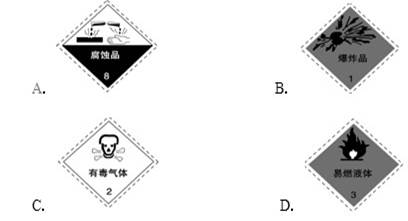
参考答案:A
本题解析:考查常见的危险品标志的识别与判断。氢氧化钠极易很强的腐蚀性,所以选项A正确,答案选A。
本题难度:简单
5、选择题 下列除杂质的操作中不正确的是 (??? )
A.铁粉中混有铝粉:加入过量烧碱溶液充分反应、过滤
B.CO2中混有HCl:将其通入NaOH溶液
C.NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体
D.NaCl溶液中混有少量I2:加入适量CCl4 ,振荡,静置,分液
参考答案:B
本题解析:铝与氢氧化钠溶液反应但铁不反应,A可以;HCl与CO2均与NaOH溶液反应,B错误应该选用饱和NaHCO3溶液;Na2CO3+CO2+H2O=2NaHCO3,C可以;I2在CCl4中的溶解度大可以萃取除去,D可以;答案选B。
本题难度:一般
|