微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化学反应中,既是氧化还原反应,又可以用离子方程式表示的为( )
A.铁粉放入硫酸铜溶液
B.CO2气体通入澄清石灰水
C.大理石高温分解
D.KClO3在MnO2催化下加热制O2
参考答案:A、铁片置于硫酸铜溶液中是置换反应,也有离子参加反应,则既是
本题解析:
本题难度:一般
2、填空题 已知KMnO4?可以与浓盐酸反应制取氯气.紫色KMnO4溶液在不同条件下的还原过程如下:①MnO4-+e-→MnO42-(绿色)?(强碱性条件)
②MnO4-+8H++5e-→Mn2+(无色)+4H2O(强酸性条件)
(1)将KMnO4溶液滴入?KOH与?K2SO3的混合溶液发生化学反应,还原剂为______,还原产物为______.(填写化学式)
(2)将KMnO4溶液滴入NaOH溶液微热,得到透明的绿色溶液,反应的离子方程式为______.
(3)用酸性KMnO4溶液与亚铁盐的反应证明Fe2+具有还原性,最合适的亚铁盐是______,可用来酸化KMnO4溶液的试剂是______(均选填字母编号).
a.FeSO4???b.FeCl2???c.Fe(NO3)2???d.盐酸???e.稀硝酸???f.稀硫酸
(4)向20mL浓度为0.02mol/L的KMnO4溶液中滴加FeSO4溶液,使紫色MnO4-全部转化为无色,则反应前需向KMnO4溶液加入c(H+)=1mol/L的酸不少于______mL.
参考答案:(1)KMnO4具有强氧化性,在碱性溶液中与K2SO3发生氧
本题解析:
本题难度:一般
3、填空题 在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中,______元素被氧化,______是氧化剂,还原产物是______,电子转移的数目是______.
参考答案:在K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl
本题解析:
本题难度:一般
4、简答题 NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
(1)工业上可用氯化钠为原料,通过电解的方法制得NaClO,工业上制取NaClO的离子反应方程式为______?电解后的溶液PH______?7(填大于、小于、等于);其原因是______?(用离子方程式表示)
(2)KAl(SO4)2溶液中质子守恒等式为______
(3)某小组同学用下图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验.
①打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀.此时反应的离子方程式为______.②将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生,充分反应后集气瓶中收集到一种无色无味的气体.写出在光照射下混合液中反应的化学方程式是______.
(4)若将分液漏斗中的KAl(SO4)2溶液换成硫酸亚铁铵(一种复盐:(NH4)2SO4?FeSO4)溶液,其他不变.打开分液漏斗活塞向烧瓶中滴入足量的硫酸亚铁铵溶液.观察到烧瓶中有红褐色沉淀产生,但是没有观察到黄绿色气体产生.此时烧瓶中发生的氧化还原反应的离子方程式为______.
(5)取100mL?0.1mol/L?Ba(OH)2溶液,向其中逐滴加入同浓度的KHSO4溶液至Ba2+恰好完全沉淀,此时溶液的PH值为______?(忽略两溶液混合时的体积变化,混合后溶液的温度为100℃,100℃时Kw=1x10-12)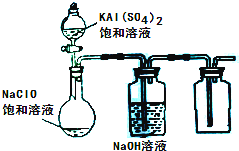
参考答案:(1)电解饱和食盐水得到氯气、氢气、氢氧化钠溶液,氯气和氢氧
本题解析:
本题难度:一般
5、选择题 “嫦娥二号”的制造使用了铝-锂、铝-镁等多种合金材料,火箭推进剂中发生反应:N2O4+2N2H4=3N2+4H2O.下列有关叙述不正确的是( )
A.锂、铝、镁都属于金属单质
B.火箭推进剂中发生的反应属于氧化还原反应
C.16?g?N2H4中含有的H原子数为1.204×1023
D.N2O4属于氧化物
参考答案:A.铝-锂、铝-镁合金中,锂、铝、镁以单质形式存在,故A正确
本题解析:
本题难度:一般