微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
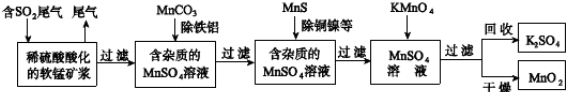
请回答下列问题:
(1)上述流程脱硫实现了 (选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)过滤操作用到的玻璃仪器有: 。
(3)用MnCO3能除去溶液中Al3+和Fe3+,其原因是 。
(4)写出KMnO4溶液加入到MnSO4溶液中制备MnO2的离子反应方程式: 91exam .org; ;用惰性电极电解MnSO4溶液也可制得MnO2,其阳极的电极反应式是 。
(5)MnO2是碱性锌锰电池的电极材料,电池反应方程式为:2MnO2+Zn+H2O====2MnOOH+Zn(OH)2,写出该电池放电时,正极的电极反应式是 。
参考答案:(1)A、C(2)烧杯、漏斗、玻璃棒
(3)消耗溶液中
本题解析:
试题分析:(1)白色污染主要是塑料等难降解的物质形成的,SO2能形成酸雨,因此脱硫实现了废弃物的综合利用,同时也减少了酸雨形成,即答案选AC。(2)由于碳酸锰能消耗溶液中的酸,降低溶液的酸性,从而促进Al3+和Fe3+水解生成氢氧化物沉淀。(3)已知:热化学方程式①Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol,②S(s)+O2(g)=SO2(g) △H=-297kJ/mol,③Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol,则根据盖斯定律可知③-(①+③)即得到SO2与MnO2反应生成无水MnSO4的热化学方程式MnO2(s)+SO2(g) =MnSO4(s) △H=-248kJ/mol。(4)电解池中阳极失去电子发生氧化反应,则用惰性电极电解MnSO4溶液可制得MnO2,因此阳极是锰离子放电,其阳极电极反应式是Mn2++2H2O-2e-=MnO2+4H+。(5)原电池中负极失去电子,正极得到电子,因此碱性锌锰电池放电时,正极是二氧化锰得到电子,则电极反应式是MnO2+H2O+e-=MnO(OH)+OH-。(6)实际参加反应的SO2的物质的量是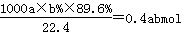 ,根据方程式MnO2(s)+SO2(g) =MnSO4(s)可知生成硫酸镁的物质的量是0.4abmol。最终生成二氧化锰是c kg,则根据方程式3MnSO4+2KMnO4+2H2O=5MnO2+K2SO4+2H2SO4可知,因此消耗硫酸锰的物质的量是
,根据方程式MnO2(s)+SO2(g) =MnSO4(s)可知生成硫酸镁的物质的量是0.4abmol。最终生成二氧化锰是c kg,则根据方程式3MnSO4+2KMnO4+2H2O=5MnO2+K2SO4+2H2SO4可知,因此消耗硫酸锰的物质的量是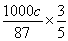 mol,则除去铁、铝、铜、镍等杂质时,所引入的锰元素的物质的量是
mol,则除去铁、铝、铜、镍等杂质时,所引入的锰元素的物质的量是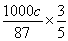 mol-0.4abmol,相当于二氧化锰的质量是(
mol-0.4abmol,相当于二氧化锰的质量是(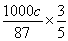 mol-0.4abmol)×87g/mol=(600c-34.8ab)g=
mol-0.4abmol)×87g/mol=(600c-34.8ab)g=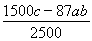 kg
kg
考点:考查物质制备工艺流程的有关判断与计算
本题难度:困难
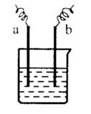
2、选择题 (08年成都诊断,11)右图中,两电极上发生的电极反应如下:a极: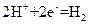 ↑,
↑,
b极: -2
-2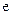 =
= 。则以下说法不正确的是(?)
。则以下说法不正确的是(?)
A.该装置可能是电解池
B.该装置中电解质溶液pH可能等于7
C.a、b可能是同种电极材料
D.该过程中能量的转换一定是化学能转化为电能
参考答案:D
本题解析:本题考查原电池和电解池,较难题。该装置为原电池时,则b为负极,材料为Zn,a为正极,材料为活动性比Zn弱的金属,电解质溶液为非氧化性酸溶液;该装置为电解池时,b极为阳极,材料为Zn,a极为阴极,材料可为活性电极或惰性电极,电解质溶液为活泼金属的盐溶液。因此该装置既可能为原电池,也可能为电解池,A对,D错;该装置为电解池时,电解质为NaCl时,pH=7,B对;该装置为电解池时,电极材料均可为Zn,C对。
本题难度:一般
3、填空题 锌-锰干电池是普遍使用的化学电池,其中含有MnO2、NH4Cl、ZnCl2等糊状物。以锌筒为负极材料,石墨为正极材料。
工作时反应方程式是: Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O
(1)试写出干电池放电时的正、负电极反应式:正极:_____________负极:_____________;干电池用久了就会变软,其原因是_______________。
(2)正极反应中,前后经历下列反应:2NH4++2e-=2NH3+H2;2MnO2+H2=Mn2O3+H2O,如果没有MnO2参与,干电池将难于持续稳定工作。试说明理由:_____________________________。
参考答案:(1)正极:2NH4++2MnO2+2e-=2NH3+Mn2
本题解析:
本题难度:一般
4、选择题 由NaCl和CuSO4组成的混合溶液中C(Na+)=3(Cu2+)=0.3 mol·L-1,取该混合液100 mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112 L(标准状况)气体.若溶液体积仍为100 mL,此时溶液的pH为
A.14
B.2
C.12
D.13
参考答案:D
本题解析:
本题难度:困难
5、填空题 (14分)据图回答下列问题:
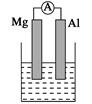
Ⅰ、(1)若烧杯中溶液为稀硫酸,则观察到的现象是 ___________________
负极反应式为:______________________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________(填Mg或Al),总反应化学方程式为____________________________________。
Ⅱ、由Al、Cu、浓硝酸组成原电池,其正极的电极反应式为
Ⅲ、中国科学院长春应用化学研究所在甲醇燃料电池技 术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。

①该电池工作时,b口通入的物质为_______,
c口通入的物质为______。
②该电池负极的电极反应式为:_______
③工作一段时间后,当12.8 g甲醇完全反应生成CO2时,______________NA个电子转移。
参考答案:(14分)I(1)Mg逐渐溶解 Al
本题解析:
试题分析:I、(1)若烧杯中溶液为稀硫酸,则Mg与稀硫酸反应,所以Mg作负极,Al作正极,实验现象是Mg逐渐溶解、Al片上有气泡冒出、指针偏转;负极的反应式为Mg-2e-=Mg2+;
(2)若烧杯中溶液为氢氧化钠溶液,则Al与氢氧化钠反应,所以Al作负极,总反应即是Al与NaOH的反应,化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
II、Al与浓硝酸发生钝化,所以Cu与浓硝酸反应,则Cu作负极,正极是NO3-发生还原反应生成二氧化氮,电极反应式为NO3-+e-+H+=NO2↑+H2O;
III、①根据图中氢离子的移动方向判断右侧是正极,左侧是负极,负极通入甲醇,所以b口通入的物质是CH3OH,正极通入的是空气或氧气,所以c口通入的是空气或氧气;
②负极发生氧化反应,根据图中所给信息,甲醇发生氧化反应后生成二氧化碳和氢离子,电极反应式为CH3OH-6e-+H2O=CO2+6H+;
③12.8 g甲醇完全转化为二氧化碳时,转移电子的物质的量是12.8g/32g/mol×6=2.4mol。
考点:考查原电池反应原理,正负极的判断、电极反应式的书写,氧化还原反应的计算
本题难度:一般