微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 晶胞是晶体中最小的重复单位,数目巨大的晶胞无隙并置构成晶体.NaCl晶体是一个正六面体(如图一).我们把阴、阳离子看成不等径的圆球,并彼此相切(已知a为常数).
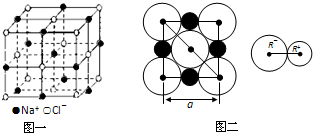
请计算下列问题:
(1)每个晶胞平均分摊______个Na+,______个Cl-.
(2)NaCl晶体中阴阳离子的最短距离为______(用a表示).
(3)NaCl晶体为“巨分子”,在高温下(≥1413℃时)晶体转变成气态团簇分子.现有1molNaCl晶体,加强热使其气化,测得气体体积为11.2L(已折算为标准状况).则此时氯化钠气体的分子式为______.
参考答案:(1)该晶胞中钠离子个数=12×
本题解析:
本题难度:一般
2、选择题 关于化学键的下列说法正确的是????????????????????(???)
A.构成离子晶体的作用力可能是离子键也可能是共价键
B.氯化铯晶体是由氯化铯分子构成的
C.由于离子的带电量有限,一个离子可以同时吸引的带相反电荷的离子数也有限
D.一种离子化合物如果适合作耐高温材料,它的晶格能一定相当大
参考答案:
D
本题解析:
学习物质结构和性质时,要求了解的具体事物不是太多,主要是概念辨析和规律的运用。A项的说法是一些读书马虎的同学易犯的认知错误。要知道把阴、阳离子结合成晶体的作用力就是离子键。离子晶体虽然可能含共价键,但这时共价键只存在于原子团离子内部,是构成原子团的作用力,而不是构成整个离子晶体的作用力。B项中氯化铯晶体是离子晶体,离子晶体不存在分子,所以不可能是由分子构成。C项错误,离子键没有饱和性。D项是正确的。耐高温材料当然要求熔点高,熔点高的晶体晶格能大。
本题难度:一般
3、填空题 (11分)T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
元素
| 相关信息
|
T
| T原子所处的周期数、族序数分别与其原子序数相等
|
X
| X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同
|
Z
| Z的基态原子价电子排布为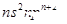
|
Q
| 在该元素所在周期中,Q的基态原子的第一电离能最小
|
R
| 3p能级上有1个电子
|
W
| W的一种核素的质量数为65,中子数为36
(1)X、Y、Q三种元素的电负性由大到小的顺序是????????(用元素符号表示)。
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要?????(填“高”、“低”)。
(3)W2+的核外电子排布式为?????????。元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示错误的是???????
A.氧化剂是O2???????????????????? B.HO2在碱中不能稳定存在
C.氧化产物是HO2????????? D.1 molW参加反应有1 mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子。其中A、B、C均为10电子微粒,D为18电子微粒。A为5原子核的+1价阳离子,则A+的中心原子杂化方式为_______. B为4原子核的+1价阳离子,则B+电子式为___________。C为4个原子核构成的分子,则与C互为等电子体的分子可以是_______(写结构式)。D分子中两元素的原子个数之比为1:1,则D为????(填“极性”或“非极性”)分子。某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为______________________。
(5)已知25℃、101 kPa条件下:
4R(s)+3Z2(g)????2R2Z3(s)?△H=-2835.9 kJ/mol
4R(s)+2Z3(g)????2R2Z3(s)?△H=-3119.1 kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H=????????????.
参考答案:1)N>C>Na??(2)高????(3)[Ar]3d9或1
本题解析:根据元素的结构及其性质可知,T、X、Y、Z、Q、R、W分别是H、C、N、O、Na、Al、Cu。
(1)非金属性越强,电负性越大,所以X、Y、Q三种元素的电负性由大到小的顺序是N>C>Na。
(2),晶体结构与金刚石类似,石墨是原子晶体。由于碳原子半径大于氮原子半径,原子半径越小,共价键越强,所以该晶体的熔点大于金刚石的。
(3)根据构造原理可知,铜离子的电子排布式为[Ar]3d9或1s22s22p63s23p63d9。根据方程式可知,氧气是氧化剂,所以HO2是还原产物,选项C不正确,其余
本题难度:一般
4、选择题 下列物质的熔、沸点高低顺序正确的是(???)
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4>CBr4>CCl4>CF4
C.K2O>Na2O>O2>N2
D.干冰 >二氧化硅>氯化钠>钠
参考答案:B
本题解析:一般情况下原子晶体的熔沸点最高,其次是离子晶体(或金属晶体),分子晶体的熔沸点最低。A全部是原子晶体,形成原子晶体共价键的原子半径越小,共价键越强,原子半径是Si>C>O,所以应该是金刚石>碳化硅>二氧化硅>晶体硅,A不正确。B中全部是分子晶体,对于组成和结构相似的分子晶体来讲,相对分子质量越大,熔沸点越高,因此B正确。形成离子晶体的离子键越强,熔沸点越高。形成离子键的离子半径越小,所带电荷数越多,离子键越强,所以C中的正确顺序为Na2O> K2O >O2>N2,C错误。D中应为二氧化硅>氯化钠>钠>干冰
本题难度:一般
5、填空题 如图所示的甲、乙、丙三种晶体
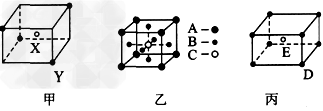
?试推断甲晶体化学式(X为阳离子)为____,乙晶体中A、B、C三种微粒的个数比是
____,丙晶体中每个D微粒周围结合E微粒的个数是________个。
参考答案:X2Y;1:3:1;8
本题解析:
本题难度:一般
|