微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 原电池是一种将______能转化为电能的装置.图所示的原电池中,锌片上发生______反应(填“氧化”或“还原”).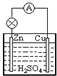
参考答案:原电池是将化学能直接转换为电能的装置,在Zn、Cu、硫酸构成
本题解析:
本题难度:一般
2、填空题 (7分)(1)写出一个能证明还原性Fe比Cu强的离子方程式:
;
(2)根据上述反应设计一个原电池,画出简易装置图(标出电极名称、电极材料、电解质溶液)
;
(3)若该电池中两电极的总质量为60 g,工作一段时间后,取出两电极洗净干燥后称量,总质量为46 g,则反应过程中转移电子的数目为 。
参考答案:1)Fe+ Cu2+=Fe2++Cu
(2)
本题解析:略
本题难度:一般
3、填空题 铅蓄电池其电极分别是Pb、PbO2,电解质是一定浓度的硫酸,工作时的反应方程式为:PbO2+Pb+2H2SO4=2PbSO4+2H2O试分别写出其电极反应式。请写出放电时的电极反应。
参考答案:负极:Pb+SO42--2e=PbSO4正极:PbO2+4H
本题解析:在负极Pb失去电子,发生氧化反应;在正极PbO2得到电子,发生还原反应。
本题难度:简单
4、填空题 氮是地球上含量丰富的一种元素,氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
Ⅰ.(1)N2H4中的N原子最外层达到8电子稳定结构,写出N2H4的结构式_____________。
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为????????????????。
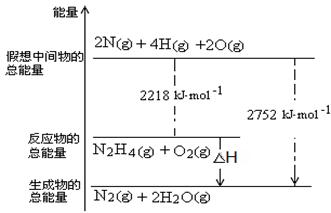
(3)肼是一种高能燃料,有关化学反应的能量变化如右图所示,写出肼燃烧的热化学方程式????????????????????????????????????。
Ⅱ.氨的合成是最重要的化工生产之一。已知:
N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ·mol-1
2NH3(g)ΔH=-92.4 kJ·mol-1
在3个体积均为2L的密闭容器中,在相同的温度下,使用相同的催化剂合成氨,实验测得反应在起始、达到平衡时的有关数据如下表所示:????

试回答:
(1)下列各项能说明该反应已达到平衡状态的是______________(填写序号字母)。
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)分析上表数据,下列关系正确的是_________(填写序号字母)。
A.2c1>1.5mol·L-1
B.w3=w1
C.2ρ1=ρ2
D.K甲= K乙= K丙
(3)容器乙中反应从开始到达平衡平均速率为v(H2)= _____________。
III.直接供氨式碱性燃料电池的电池反应式是4NH3+3O2=2N2+6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是__________????????。
参考答案:Ⅰ.(1) 本题解析:
本题解析:
试题分析:Ⅰ.(1)N2H4中的N原子可达到8电子的稳定结构,氮原子最外层3个电子形成三对共用电子对,和未成键的一对电子形成8电子稳定结构,每个氮原子和两个氢原子形成共价键,氮原子间形成一个共价键,结构式为: ,故答案为:
,故答案为: 本题难度:一般
本题难度:一般
5、选择题 镍—镉可充电电池可发生如下反应:Cd(OH)2+2Ni(OH)2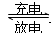 Cd+2NiO(OH)+2H2O,由此可知,该电池的负极材料是(?)
Cd+2NiO(OH)+2H2O,由此可知,该电池的负极材料是(?)
A.Cd
B.NiO(OH)
C.Cd(OH)2
D.Ni(OH)2
参考答案:A
本题解析:充电相当于电解池,放电相当于原电池。在原电池中较活泼的金属作负极,失去电子,发生氧化反应。所以根据反应式可知放电时Cd是还原剂,失去电子,作负极,因此答案选A。
本题难度:一般