微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 实验室欲配制100mL?2mol?L-1的KOH溶液,试回答:
(1)用不到的仪器是(用字母表示)______.
A.烧杯 B.200mL容量瓶 C.量筒 D.胶头滴管 E.玻璃棒:F.100mL容量瓶
(2)配制时应称取KOH______g.
(3)实验开始时,需检查容量瓶______.
(4)下列操作的顺序是(用字母表示)______.A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移
(5)若用2mol?L-1的KOH溶液润洗容量瓶,实验结果使溶液浓度将______.
参考答案:(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇
本题解析:
本题难度:一般
2、选择题 在NaCl、MgCl2、MgSO4三种盐配制的混合液中,Na+为0.1mol,Mg2+为0.25mol,Cl-为0.2mol,则SO为( )
A.0.5?mol
B.0.15?mol
C.0.25?mol
D.0.2?mol
参考答案:根据溶液中阴阳离子所带的正负电荷总数相等,则有n(Na+)+
本题解析:
本题难度:一般
3、选择题 已知0.5 L盐酸和硫酸的混合溶液中含有0.1 mol Cl-和0.2 mol SO42-,则此溶液中H+的物质的量浓度是:( )
A.1 mol/L
B.0.5 mol/L
C.0.6 mol/L
D.0.1 mol/L
参考答案:A
本题解析:
试题分析:根据电荷守恒:n(H+)= n(Cl-)+ 2n(SO42-),所以n(H+)=0.5mol,c(H+)=1mol/L。答案选A。
考点:电荷守恒计算浓度
点评:电荷守恒在很多计算中都起到举足轻重的作用。
本题难度:一般
4、选择题 若NA表示阿伏加德罗常数,下列叙述中正确的是
A.标准状况下,22.4 LSO3含NA个分子
B.6.4 g S6与S8的混合物中所含S原子数一定为0.4NA
C.1.7 g H2O2中含有的电子数为0.9 NA
D.1 mol Na2O2固体中含离子总数为4 NA
参考答案:C
本题解析:A 错误,标准状况下,SO3是固体,不是气体
B 错误,所含S原子数一定为0.1NA
C 正确,H2O2是18电子分子,1.7 g H2O2是0.05mol,含电子数为0.9 NA
D 错误,1 mol Na2O2固体中含离子总数为3NA
本题难度:一般
5、填空题 (4分)用质量分数为98%、密度为1.84g·cm-3的浓硫酸配制100mL 1.84mol·L-1的稀硫酸,若实验仪器有:
A.100mL量筒;
B.托盘天平;
C.玻璃棒;
D.50mL容量瓶;
E.10mL量筒,F.胶头滴管;G.50mL烧杯;H.100mL容量瓶
实验时应选用仪器的先后顺序是(填入编号):_______________________________。
参考答案:EFGCHF (4分)
本题解析:
试题分析:需要浓硫酸的体积是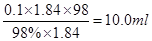 ,所以需要10ml量筒,量取时还需要胶头滴管。浓硫酸的稀释需要烧杯玻璃棒,转移到100ml容量瓶中,而定容时还需要胶头滴管,所以实验时应选用仪器的先后顺序是EFGCHF。
,所以需要10ml量筒,量取时还需要胶头滴管。浓硫酸的稀释需要烧杯玻璃棒,转移到100ml容量瓶中,而定容时还需要胶头滴管,所以实验时应选用仪器的先后顺序是EFGCHF。
考点:考查一定物质的量浓度溶液的配制
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以要求学生必须熟练掌握。
本题难度:一般