微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 钠氯化镍蓄电池是一种新型的电动汽车蓄电池,其正极MCl2中的M代表Ni、Fe、Ca、Cr、Mn、Cu等一系列金属,其中NiCl2的效果最好。而负极的活性物质是液态金属钠。正、负极活性物质被一种只允许Na+迁移的β-Al2O3固体电解质陶瓷管分隔,由于正极是固态多孔金属氧化物,所以还需要添加NaAlCl4熔盐在正极处作第二电解质,在正、负极之间传导钠离子。下列有关钠氯化镍蓄电池的说法错误的是
A.电池放电时的总反应为2Na+NiCl2===Ni+2NaCl
B.充电时阳极的电极反应为Na++e-===Na
C.放电时正极的电极反应为Ni2++2e-===Ni
D.该电池被称为绿色电池,最大原因是从废弃电池中可以方便地回收较纯的镍,其他产物对环境没有影响
参考答案:B
本题解析:
试题分析:该蓄电池放电时,负极反应为Na-e-===Na+,正极反应为Ni2++2e-===Ni,总反应式为2Na+NiCl2===Ni+2NaCl,故A、C正确;充电时,阴极电极反应为Na++e-===Na,故B错误。
点评:本题考查了蓄电池充放电时的电极反应,明确电池的正负极以及发生的反应是解题的关键。难度不大
本题难度:简单
2、选择题 蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”。关于标有“+”的接线柱,下列说法中正确的是
A.充电时作阳极,放电时作正极
B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极
D.充电时作阴极,放电时作正极
参考答案:A
本题解析:蓄电池是可充电电池,放电时是原电池,充电是遵循电解池原理
标有“+”的接线柱是原电池的正极,得电子,发生还原反应;而充电时需失电子,发生氧化反应,为阳极,答案为A
本题难度:一般
3、选择题 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极)。下列说法中正确的是(???)
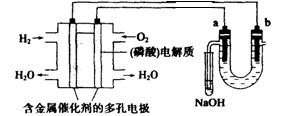
A.电池工作时,正极反应式为:O2+2H2O+4e- ="==" 4OH-
B.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
C.电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
D.当电池中消耗0.02gH2时,a极周围会产生0.02gH2
参考答案:C
本题解析:左侧是原电池,右侧是电解池。在原电池电解质是酸性溶液,所以正极反应式为O2+4H++4e- ="==" 2H2O。电子只能通过导线传递,而不能通过溶液传递。a极是阳极,OH-放电生成氧气,所以正确的答案是C。
本题难度:一般
4、填空题 (14分)运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)某硝酸厂处理尾气中NO的方法是:催化剂存在时用H2将NO还原为N2。已知:
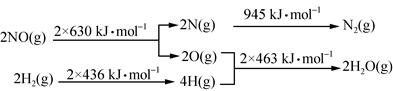
则氮气和水蒸气反应生成氢气和一氧化氮的热化学方程式是 。
(2)在压强为0.1 Mpa条件,将a mol CO和3a mol H2的混合气体在催化剂作用下转化为甲醇的反应如下:CO(g)+2H2(g) CH3OH(g) ΔH<0。
CH3OH(g) ΔH<0。
①该反应的平衡常数表达式为________________。
②若容器容积不变,下列措施可增大甲醇产率的是________。
A.升高温度
B.将CH3OH从体系中分离
C.充入He,使体系总压强增大
(3)某研究小组在实验室研究某催化剂效果时,测得NO转化为N2的转化率随温度变化情况如图。
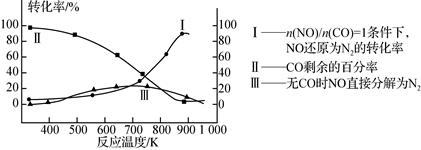
①若不使用CO,温度超过775 ℃,发现NO的分解率降低,其可能的原因为________;在n(NO)/n(CO)=1的条件下,应控制最佳温度在________左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染。

写出C2H6与NO2发生反应的化学方程式________________。
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,则该电极反应式为________________________。
参考答案:(1)N2(g)+2H2O(g)===2NO(g)+2H2(
本题解析:
试题分析:(1)化学反应方程式为N2+2H2O===2NO+2H2,由图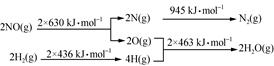 可知,ΔH=945+4×463-2×630-2×436=+665 kJ·mol-1,故热化学方程式为N2(g)+2H2O(g)===2NO(g)+2H2(g) ΔH=+665 kJ·mol-1;
可知,ΔH=945+4×463-2×630-2×436=+665 kJ·mol-1,故热化学方程式为N2(g)+2H2O(g)===2NO(g)+2H2(g) ΔH=+665 kJ·mol-1;
(2)由热化学方程式CO(g)+2H2(g) CH3OH(g) ΔH<0可知,平衡常数K=
CH3OH(g) ΔH<0可知,平衡常数K=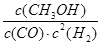 ;欲增大甲醇产率,则应使该平衡正向移动,升高温度,平衡向着吸热的方向移动,该平衡逆移, 将CH3OH从体系中分离,可使平衡正移,充入He,使体系总压强增大,该平衡不移动,故选择B;
;欲增大甲醇产率,则应使该平衡正向移动,升高温度,平衡向着吸热的方向移动,该平衡逆移, 将CH3OH从体系中分离,可使平衡正移,充入He,使体系总压强增大,该平衡不移动,故选择B;
(3)①由图可知,若不使用CO,温度超过775 ℃,发现NO的分解率降低,则该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在n(NO)/n(CO)=1的条件下,应控制最佳温度在850-900℃之间;
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染,C2H6与NO2反应,生成无污染的N2和CO2,反应方程式为4C2H6+14NO2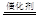 8CO2+7N2+12H2O;
8CO2+7N2+12H2O;
(4)以NO2、O2、熔融NaNO3组成的燃料电池,由图可知,石墨Ⅰ为燃料电池的负极,负极失电子,生成一种氧化物Y,电极反应为NO2+NO3--e-===N2O5。
考点:热化学方程式的书写,平衡常数的计算,化学平衡的移动,图像的描述,化学反应方程式的书写,电极反应的书写
本题难度:困难
5、填空题 (l)铝与某些金属氧化物在高温下的反应称为铝热反应,可用于冶炼高熔点金属。
已知:4Al(s)+3O2(g)=2Al2O3(s)  =-2830kJ·mol-1
=-2830kJ·mol-1
 ?
? =+230kJ·mol-1
=+230kJ·mol-1
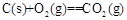 ?
? =-390kJ·mol-1
=-390kJ·mol-1
铝与氧化铁发生铝热反应的热化学方程式是??????????????????。
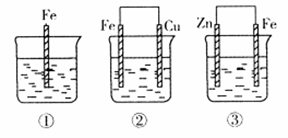
(2)如下图所示,各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是???????????;
②装置中Cu电极上的电极反应式为??????????????????????????????????????????。
(3)钒(V)及其化合物广泛应用于新能源领域。全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示。

①当左槽溶液逐渐由黄变蓝,其电极反应式为???????????????????????????????????????。
②充电过程中,右槽溶液颜色逐渐由??????色变为?????色。
参考答案:(9分)
(1)2Al(s)+Fe2O3(s)= Al
本题解析:
试题分析:。
(1)分别标记三个方程式为①式、②式、③式,根据盖斯定律①式-②式×2-③式×3得2Al(s)+Fe2O3(s)= Al 2O3(s)+ 2Fe(s) △H=-600kJ·mol 。
(2)腐蚀速率:电化学腐蚀>化学腐蚀>被保护的腐蚀,所以②>①>③;②装置中Cu电极为正极,O2放电,O2+2H2O+4e-=4OH-。
(3)观察图片,①VO2-(黄色)、 VO2+(蓝色),其电极反应式为VO2-+2H++e-= VO2++ H2O。②充电过
本题难度:一般