微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把500mL含有BaCl2和KCl的混合溶液分成2等份,取一份加入含a mol 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液,恰好使氯离子完全沉淀。则该溶液中钾离子浓度为:
A.0.1(b-2a)mol/L
B.10(b-2a)mol/L
C.10(2a-b)mol/L
D.4(b-2a)mol/L
参考答案:D
本题解析:
试题分析:题中发生的离子方程式为:Ba2++SO42-=BaSO4↓, Ag++Cl-=AgCl↓;一份加入a molSO42-,原溶液中BaCl2为a mol,同时电离出Cl-2amol,又因另一份加入b mol Ag+,所以溶液中Cl-总量为b mol,结合前者,KCl的物质的量为b-2amol,又因将混合液分成2等分,所以其总量为2(b-2a),结合题意即可求得钾离子的浓度。
考点:溶液中离子浓度的计算。
本题难度:一般
2、选择题 在体积为x L的密闭容器中通入a mol?NO和b mol?O2,反应后容器内氮原子数和氧原子数之比为( )
A.
a
b
B.a
2b
C.a
(a+2b)
D.a
2(a+b)
参考答案:C
本题解析:
本题难度:简单
3、填空题 (10分)
(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为 _______ 。
(2) 等质量的CH4与 NH所含电子数之比是___ ,质子数之比是___ 。
(3)相同条件下,体积比为a∶b和质量比为a∶b的H2和O2的混合气体,其平均相对分子质量分别为_ ; ___ 。
参考答案:(10分;每空各2分)(1)64 &#
本题解析:
试题分析:(1)标准状况下体积是672mL的气体的物质的量是0.672L/22.4L/mol=0.03mol,根据M=m/n,得该气体的摩尔质量数值上等于相对分子质量=1.92/0.03=64;
(2)甲烷与铵根离子中含有是电子数相等都是10电子的微粒,而等质量的甲烷与铵根离子的物质的量之比是1/16:1/18=9:8,所以等质量的CH4与 NH所含电子数之比是也是物质的量之比是9:8;甲烷与铵根离子中的质子数之比是10:11,所以CH4与 NH所含质子数之比是9×10:8×11=90:88=45:44;
(3)相同条件下,体积比为a∶b的H2和O2的混合气体的物质的量之比也是a:b,则平均相对分子质量=(2a+32b)/(a+b);质量比为a∶b的H2和O2的混合气体的物质的量分别是a/2、b/32,所以平均相对分子质量=(a+b)/(a/2+b/32)=32(a+b)/ (16a+b)。
考点:考查气体物质的量、摩尔质量、相对分子质量的计算
本题难度:一般
4、选择题 36.5HCl溶解在1L水中(水的密度近似为1gml),所得溶液的密度为ρg/ml,质量分数为ω,物质的量溶液为c mol/L,NA表示阿伏加德罗常数,则下列叙述中正确的是(???)
A.所得溶液的物质的量浓度:c=1mol/L
B.所得溶液中含有NA个HCl分子
C.36.5g HCl气体占有的体积为22.4L
D.所得溶液的质量分数:ω=36.5c/(1000ρ)
参考答案:D
本题解析:
36.5gHCl溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为ρg/ml,质量分数为ω,物质的量浓度为c mol/L,NA表示阿伏加德罗常数;
A、不正确,溶液溶质为氯化氢,物质的量浓度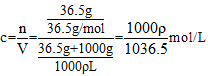
B、不正确,氯化氢溶于水形成盐酸溶液是强电解质,溶液中无氯化氢分子;
C、不正确,3
本题难度:一般
5、选择题 下列叙述正确的是
A.1 mol H2O的质量为18g/mol
B.CO2的摩尔质量为44g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1 mol任何物质体积均为22.4L
参考答案:C
本题解析:略
本题难度:一般
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|